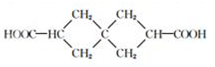
题目内容
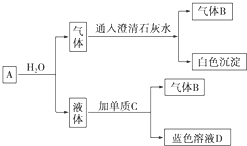
8.已知A、B、C、D、E是短周期元素,它们的原子序数逐渐增大.A元素原子形成的离子没有电子;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族; E的单质为黄色晶体,易溶于二硫化碳.(1)A的离子符号是H+;
(2)元素D在周期表中的位置是第三周期IA族.
(3)C、D的最高价氧化物的水化物相互反应的离子方程式是Al(OH)3+OH-=[Al(OH)4]-;
(4)A、B、C三种元素形成的化合物所含的化学键类型是离子键、共价键;
(5)B、C、D三种元素分别形成的离子,离子半径由大到小的顺序是O2->Na+>Al3+(用离子符号填写).
(6)写出一种由A、B、C、E四种元素组成的离子化合物的化学式:NaHSO3、NaHSO4.写出一种由A、B、E三种元素组成的共价化合物的化学式:H2SO4.
(7)将64g E单质在足量的B单质中燃烧,所得气体通入1L 3mol•L-1NaOH溶液中,完全吸收后,溶液中大量存在的阴离子是HSO3-、SO32-.
分析 A、B、C、D、E是短周期元素,它们的原子序数逐渐增大,A元素原子形成的离子没有电子,则A应为H元素;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应,应是氢氧化铝与强酸、强碱的反应,而A与C同主族,则C为Na元素、D为Al元素;E的单质为黄色晶体,易溶于二硫化碳,则E为S元素,B与E同主族,则B为O元素,据此解答.
解答 解:A、B、C、D、E是短周期元素,它们的原子序数逐渐增大,A元素原子形成的离子没有电子,则A应为H元素;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应,应是氢氧化铝与强酸、强碱的反应,而A与C同主族,则C为Na元素、D为Al元素;E的单质为黄色晶体,易溶于二硫化碳,则E为S元素,B与E同主族,则B为O元素,
(1)A的离子符号是H+,故答案为:H+;
(2)D为Na,处于周期表中第三周期IA族,故答案为:第三周期IA族;
(3)C的最高价氧化物对应水化物为NaOH,D对应的最高价氧化物的水化物是Al(OH)3,具有两性,能与NaOH溶液反应生成[Al(OH)4]-,反应的离子方程式为:Al(OH)3+OH-=[Al(OH)4]-,
故答案为:Al(OH)3+OH-=[Al(OH)4]-;
(4)A、B、C三种元素形成的化合物为NaOH,钠离子与氢氧根离子以离子键结合,O、H原子之间以共价键结合,故答案为:离子键、共价键;
(5)B、C、D三种元素的离子分别为O2-、Na+、Al3+,三种离子核外电子排布相同,离子的核电核数越大,则半径越小,故离子半径O2->Na+>Al3+,故答案为:O2->Na+>Al3+;
(6)由H、O、Na、S四种元素组成的离子化合物的化学式:NaHSO3、NaHSO4.由H、O、S三种元素组成的共价化合物有H2SO4等,
故答案为:NaHSO3、NaHSO4;H2SO4;
(7)将64g 硫单质为$\frac{64g}{32g/mol}$=2mol,完全燃烧生成二氧化硫为2mol,NaOH物质的量为1L×3mol/L=3mol,二氧化硫与氢氧化钠的物质的量之比为2:3,故发生反应:SO2+NaOH=NaHSO3,SO2+2NaOH=Na2SO3+H2O,溶液中溶质为NaHSO3、Na2SO3,设二者物质的量分别为xmol、ymol,则$\left\{\begin{array}{l}{x+y=2}\\{x+2y=3}\end{array}\right.$,解得x=y=1,故溶液中大量存在的阴离子是HSO3-、SO32-,
故答案为:HSO3-、SO32-.
点评 本题考查位置结构性质的相互关系及应用,推断元素是解题关键,侧重考查学生对基础知识的理解掌握,难度不大.

 阅读快车系列答案
阅读快车系列答案| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的KSp=6.82×10-6mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol2•L-2 | |
| B. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 | |
| C. | 将表中三种物质分别与水混合,分别加热、灼烧,最终的固体产物相同 | |
| D. | 用足量石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O |
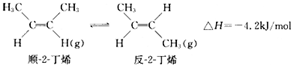
| A. | 顺-2-丁烯比反-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯大 | |
| C. | 加压和降温都有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯不能使溴水褪色 |
| A. | 原子序数:d>c>b>a | B. | 原子半径:r (A)>r (B)>r (D)>r (C) | ||
| C. | 单质的还原性:A>B>D>C | D. | 离子半径:r (C3-)>r (D-)>r (B+)>r (A2+) |
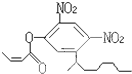 阿乐丹的结构简式可简写为如图,它在稀酸作用下能水解生成两种有机物,这两种有机物可能共同具有的性质是( )
阿乐丹的结构简式可简写为如图,它在稀酸作用下能水解生成两种有机物,这两种有机物可能共同具有的性质是( )①均能与NaOH溶液反应;②遇FeCl3溶液均显紫色;③一定条件下均能与氢气发生加成反应;④均能与溴水发生加成反应.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
 “神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )| A. | 甲物质在一定条件下可以生成有机高分子化合物 | |
| B. | 1mol乙物质可与2mol钠完全反应生成1mol氢气 | |
| C. | 甲、丙物质都能使溴的四氯化碳溶液褪色 | |
| D. | 甲在酸性条件下水解产物之一与乙互为同系物 |
正极反应:6O2+24H++24e-$\frac{\underline{\;催化剂\;}}{\;}$12H2O 负极反应:C6H12O6+6H2O-24e-$\frac{\underline{\;催化剂\;}}{\;}$6CO2↑+24H+ 则有关该电池的下列说法正确的是( )
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
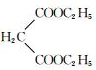 $→_{CH_{3}CH_{2}ONa}^{BrCH_{2}CH_{2}CH_{2}Br}$
$→_{CH_{3}CH_{2}ONa}^{BrCH_{2}CH_{2}CH_{2}Br}$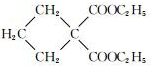 $→_{ii.H+/△}^{i.H_{2}O,OH-}$
$→_{ii.H+/△}^{i.H_{2}O,OH-}$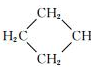 -COOH
-COOH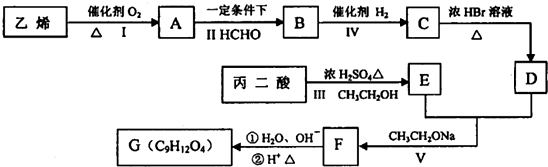
 G
G