题目内容
【题目】试回答下列各题:
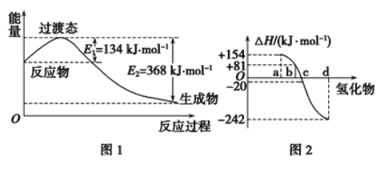
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_______________________________________。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)![]() 2HCl(g) ΔH=-185kJ·mol-1
2HCl(g) ΔH=-185kJ·mol-1
请填空:
共价键 | H-H | Cl-Cl | H-Cl |
键能/(kJ·mol-1) | 436 | 247 | ________ |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:__________。
【答案】NO2(g)+CO(g)![]() NO(g)+CO2(g) ΔH=-234kJ·mol-1 434H2Se(g)
NO(g)+CO2(g) ΔH=-234kJ·mol-1 434H2Se(g)![]() Se(s)+H2(g) ΔH=-81kJ·mol-1
Se(s)+H2(g) ΔH=-81kJ·mol-1
【解析】
(1)由图可知反应物能量高于生成物能量,反应是放热反应,反应焓变=E1-E2,依据热化学方程式书写方法写出NO2和CO反应的热化学方程式;(2)①根据△H=反应物总键能-生成物总键能计算;②根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式。
(1)结构NO2和CO反应生成CO2和NO过程中能量变化示意图可知,反应物能量高于生成物能量,反应是放热反应,反应焓变=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,标注物质聚集状态和对应焓变,写出NO2和CO反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol。(2)①△H=反应物总键能-生成物总键能=(436kJ/mol+247kJ/mol)-2E(H-Cl)=-185kJ/mol,解得:E(H-Cl)=434kJ/mol;②非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定,而能量越低越稳定,所以a、b、c、d依次为:H2Te、H2Se、H2S、H2O;b为硒化氢的生成热数据,则硒化氢分解吸热,△H=-81kJ/mol,所以H2Se发生分解反应的热化学反应方程式为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】I:已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
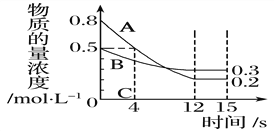
(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为_______________________
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1; 乙:v(B)=0.12 mol·L-1·s-1; 丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为__________________(用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_______________________________________________________
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________(填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g)![]() 2HI(g)已达平衡状态的是______________________
2HI(g)已达平衡状态的是______________________
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
E.温度和体积一定时,容器内压强不再变化
F.温度和体积一定时,混合气体的密度不再变化