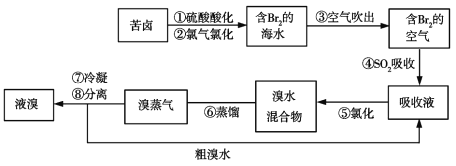
题目内容
【题目】以重晶石(主要成分为BaSO4)为主要原料制备立德粉(ZnS和BaSO4的混合物)的工艺流程如下:
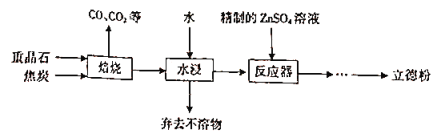
(1)焙烧(温度为1000~2000)时,焦炭需过量,其目的是____________________。
(2)焙烧过程中发生的反应之一是4CO+BaSO4![]() BaS+4CO2,该反应的氧化剂与还原剂的物质的量之比为_________________,还原产物是___________。
BaS+4CO2,该反应的氧化剂与还原剂的物质的量之比为_________________,还原产物是___________。
(3)反应器中发生反应的化学方程式为______________________。
(4)流程中所需的精制的ZnsO,溶液的制取方法是:首先用工业级氧化锌(含少量FeO和Fe2O3杂质)和稀硫酸反应制取粗硫酸锌溶液,然后向粗硫酸锌溶液中先后加入H2O2溶液和碳酸锌精制。
①加入H2O2溶液时发生反应的离子方程式为______________________。
②加入碳酸锌的目的是________________,反应的化学方程式为_____________________。
【答案】焦炭燃烧能放出大量的热,可以提供反应所需要的条件,同时增加焦炭可以提高重晶石的利用率 1:4 BaS BaS+ZnSO4=BaSO4↓+ZnS↓ 2Fe2++H2O2+2H+=2Fe3++2H2O 先加入H2O2溶液,将亚铁离子氧化成铁离子,反应的离子方程式为,再加碳酸锌调节溶液的pH值,使Fe3+转化为红褐色氢氧化铁沉淀而除去铁元素 Fe2(SO4)3+3ZnCO3+3H2O=3ZnSO4+2Fe(OH)3+3CO2↑
【解析】
根据工艺流程可知,重晶石矿的主要成分为硫酸钡,在高温时与焦炭反应生成硫化钡和气体为CO、CO2等,所得固体再用水浸,硫化钡是可溶于水的盐,所以通过溶解过滤除去杂质,得硫化钡溶液,硫化钡溶液中加入精制的硫酸锌可得ZnS和BaSO4的混合物,
(1)硫酸钡与碳反应需要高温,焦炭燃烧能放出大量的热,可以提供反应所需要的条件,同时增加一种反应物可以提高另一种反应的转化率;
(2)化合价升高失去电子被氧化作氧化剂,化合价降低得到电子被还原作氧化剂;
(3)反应器中硫化钡与硫酸锌反应生成难溶的硫酸钡和硫化锌;
(4)用工业级氧化锌(含少量FeO和Fe2O3杂质)和硫酸制取硫酸锌溶液时,可以先加入H2O2溶液,将亚铁离子氧化成铁离子,再加碳酸锌调节溶液的pH值,使Fe3+转化为红褐色氢氧化铁沉淀而除去铁元素,根据元素守恒和电荷守恒可书写离子方程式和化学方程式。
根据工艺流程可知,重晶石矿的主要成分为硫酸钡,在高温时与焦炭反应生成硫化钡和气体为CO、CO2等,所得固体再用水浸,硫化钡是可溶于水的盐,所以通过溶解过滤除去杂质,得硫化钡溶液,硫化钡溶液中加入精制的硫酸锌可得ZnS和BaSO4的混合物,
(1)硫酸钡与碳反应需要高温,焦炭燃烧能放出大量的热,可以提供反应所需要的条件,同时增加焦炭可以提高重晶石的利用率;
(2)反应4CO(g)+BaSO4(s)![]() BaS(s)+4CO2(g)中CO中碳元素化合价由+2价升高为+4价被氧化为还原剂,BaSO4中硫元素化合价由+6价降为-2价被还原为氧化剂,BaS为还原产物,根据反应可知,氧化剂与还原剂的物质的量之比为1:4;还原产物是BaS;
BaS(s)+4CO2(g)中CO中碳元素化合价由+2价升高为+4价被氧化为还原剂,BaSO4中硫元素化合价由+6价降为-2价被还原为氧化剂,BaS为还原产物,根据反应可知,氧化剂与还原剂的物质的量之比为1:4;还原产物是BaS;
(3)反应器中硫化钡与硫酸锌反应生成难溶的硫酸钡和硫化锌,反应的化学方程式为BaS+ZnSO4=BaSO4↓+ZnS↓;
(4)用工业级氧化锌(含少量FeO和Fe2O3杂质)和硫酸制取硫酸锌溶液时,可以先加入H2O2溶液,将亚铁离子氧化成铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,再加碳酸锌调节溶液的pH值,使Fe3+转化为红褐色氢氧化铁沉淀而除去铁元素,反应的化学方程式为Fe2(SO4)3+3ZnCO3+3H2O=3ZnSO4+2Fe(OH)3+3CO2↑。

【题目】试回答下列各题:
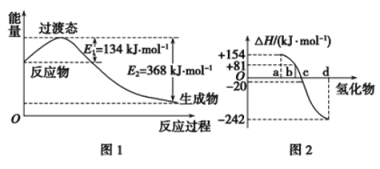
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_______________________________________。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)![]() 2HCl(g) ΔH=-185kJ·mol-1
2HCl(g) ΔH=-185kJ·mol-1
请填空:
共价键 | H-H | Cl-Cl | H-Cl |
键能/(kJ·mol-1) | 436 | 247 | ________ |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:__________。