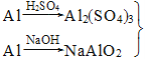题目内容
【题目】金属冶炼、电镀、电路板生产等过程会产生大量的 Cu2+,Cu2+是一种重金属离子,严重影响水生动植物的生长发育,对人体健康也有很大危害,必须经过处理达标后方可排放。某电路板生产企业的水质情况及国家允许排放的污水标准如下表:
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+(mg/L) | 1470 | ≤0.5 |
氨氮(mg/L) | 2632 | ≤15 |
Ⅰ.为研究上述废水中 Cu2+的处理方法并实现 Cu 的资源化回收,有研究者进行了如下实验: 向一定体积的废水中加入一定量废铁屑和焦炭粉,置于搅拌器上搅拌 90min、静置,经分析测得上清液中铜含量约为 72mg/L;滤出上清液,向滤液中加入一定量 FeS 固体,充分搅拌后静置,经分析测得其中铜含量已经达标。
(1)在 pH=1.0 的废水中,氨氮的主要存在形式是_____(用化学式表示)。
(2)①加入废铁屑后,废水中的铜含量明显减少,反应的离子方程式是_____
②加入焦炭可以加快反应速率,原因是_________________________________
(3)结合化学用语解释加入 FeS 固体使废水达标的原因_________________________。
(4)在处理废水过程中使用的铁粉会因表面布满一层铜膜而失效,因此要对失效的铁粉进行活化处理,同时回收铜。处理方法为:用一定浓度的氨水浸泡包覆铜膜的铁粉,露置在空气中一段时间后,可以将表面的 Cu 转化为[Cu(NH3)4]2+与铁粉分离。
请写出 Cu 转化为 [Cu(NH3)4]2+的离子方程式:_____。
Ⅱ为研究废水处理的最佳 pH,取五份等量的 I 中上清液, 分别用 30%的 NaOH 溶液调节 pH 值至 8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量。实验结果如图所示。查阅资料可知:Cu(OH)2 + 4NH3![]() [Cu(NH3)4]2+ + 2OH-。
[Cu(NH3)4]2+ + 2OH-。
(5)根据实验结果,你认为最佳的 pH 约为_____________________________。结合资料解释实验结果呈图中 b~d 段曲线所示的原因:_________________________。

【答案】NH4+ Fe+Cu2+=Cu+Fe2+ 铁屑、焦炭粉和废水中的电解质可以形成许多微小的原电池 FeS+Cu2+=CuS+Fe2+ 2Cu+O2+8 NH3H2O=2[Cu(NH3)4]2++4OH- +6H2O 9 在b~c之间,随着清液pH增大,c(OH-)增大,NH4+与OH-反应生成NH3H2O,使得c(NH3)增大,Cu(OH)2+ 4NH3![]() [Cu(NH3)4]2+ + 2OH-向正反应方向移动,故清液中的铜浓度升高;在c~d之间,随着c(OH-)增大,上述平衡向逆反应方向移动,故清液中的铜浓度又逐渐降低。
[Cu(NH3)4]2+ + 2OH-向正反应方向移动,故清液中的铜浓度升高;在c~d之间,随着c(OH-)增大,上述平衡向逆反应方向移动,故清液中的铜浓度又逐渐降低。
【解析】
由题中信息可知,向一定体积的废水中加入一定量废铁屑和焦炭粉,可以形成原电池加快铁置换铜的速率;滤出上清液,向滤液中加入一定量 FeS 固体,充分搅拌后,发生沉淀的转化,可以使其中铜含量达标。根据平衡移动原理分析图中曲线变化的原因。
(1)在 pH=1.0 的废水显酸性,根据氨气可以与酸反应生成铵盐可知,氨氮在该废水中的主要存在形式是NH4+。
(2)①铁比铜活泼,铁可以与铜盐发生置换反应,因此加入废铁屑后,废水中的铜含量明显减少,反应的离子方程式是Fe+Cu2+=Cu+Fe2+;
②废水中加入一定量废铁屑和焦炭粉后,可以形成许多微小的原电池,形成原电池可以加快化学反应速率;
(3)FeS可以与废水的Cu2+发生反应生成溶解度更小的CuS,因此,加入 FeS 固体使废水达标的原因用离子方程式可表示为FeS+Cu2+=CuS+Fe2+。
(4)用一定浓度的氨水浸泡包覆铜膜的铁粉,露置在空气中一段时间后,可以将表面的 Cu 转化为[Cu(NH3)4]2+,该反应的离子方程式为2Cu+O2+8 NH3H2O=2[Cu(NH3)4]2++4OH- +6H2O。
(5)由图中信息可知,pH约为9时,上层清液中铜元素的含量(铜浓度)最低,因此,最佳的pH约为9。由题中所给资料可知,Cu(OH)2 + 4NH3![]() [Cu(NH3)4]2+ + 2OH-。在b~c之间,随着清液pH增大,c(OH-)增大,NH4+与 OH-反应生成NH3H2O,使得c(NH3)增大,上述平衡向正反应方向移动,故清液中的铜浓度升高;在c~d之间,随着c(OH-)增大,上述平衡向逆反应方向移动,故清液中的铜浓度又逐渐降低。
[Cu(NH3)4]2+ + 2OH-。在b~c之间,随着清液pH增大,c(OH-)增大,NH4+与 OH-反应生成NH3H2O,使得c(NH3)增大,上述平衡向正反应方向移动,故清液中的铜浓度升高;在c~d之间,随着c(OH-)增大,上述平衡向逆反应方向移动,故清液中的铜浓度又逐渐降低。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案