题目内容
【题目】铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(Ⅰ)实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al![]() Al3+
Al3+![]() Al(OH)3↓
Al(OH)3↓
方案2:Al![]() AlO
AlO![]()
![]() Al(OH)3↓
Al(OH)3↓
方案3: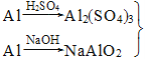 ―→Al(OH)3
―→Al(OH)3
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案________。
(Ⅱ)工业上冶炼铝的流程图如图所示:
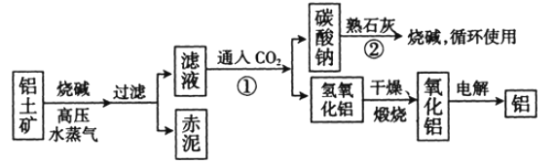
在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe2O3质量分数的数据如下:
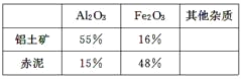
(1)书写化学方程式,反应①________,反应②________。
(2)电解氧化铝生产铝时,阳极的电极反应式为_______________________________________。
(3)假设其他杂质不参加反应,则每生产3.4 t纯净的氧化铝,需铝土矿________t。
【答案】3 2NaAlO2+CO2+3H2O===Na2CO3+2Al(OH)3↓ Na2CO3+Ca(OH)2===CaCO3↓+2NaOH 2O2--4e-===O2↑ 6.18
【解析】
(Ⅰ)根据金属铝和酸以及和碱发生反应的化学方程式来计算回答;
(Ⅱ)(1)向偏铝酸钠中通入二氧化碳反应会生成氢氧化铝沉淀,碳酸钠可以和氢氧化钙发生复分解反应;
(2)电解池中,阳极是惰性电极时,该极上是阴离子发生失电子的氧化反应;
(3)根据铝元素守恒来计算回答。
(Ⅰ)根据金属铝和酸以及和碱发生反应的化学方程式可以得出:Al~3H+~Al3+~Al(OH)3,Al~OH-~[Al(OH)4]-,Al3++3[Al(OH)4]-=4Al(OH)3↓,所以制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案3;
(Ⅱ)(1)向偏铝酸钠中通入二氧化碳反应会生成氢氧化铝沉淀,即2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓,碳酸钠可以和氢氧化钙发生复分解反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)电解池中,阳极是惰性电极时,该极上是阴离子O2-发生失电子的氧化反应:2O2--4e-=O2↑;
(3)根据铝土矿中氧化铝的质量分数为55%,所以每生产3.4t纯净的氧化铝,需铝土矿的质量:![]() =6.18t。
=6.18t。

 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】金属冶炼、电镀、电路板生产等过程会产生大量的 Cu2+,Cu2+是一种重金属离子,严重影响水生动植物的生长发育,对人体健康也有很大危害,必须经过处理达标后方可排放。某电路板生产企业的水质情况及国家允许排放的污水标准如下表:
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+(mg/L) | 1470 | ≤0.5 |
氨氮(mg/L) | 2632 | ≤15 |
Ⅰ.为研究上述废水中 Cu2+的处理方法并实现 Cu 的资源化回收,有研究者进行了如下实验: 向一定体积的废水中加入一定量废铁屑和焦炭粉,置于搅拌器上搅拌 90min、静置,经分析测得上清液中铜含量约为 72mg/L;滤出上清液,向滤液中加入一定量 FeS 固体,充分搅拌后静置,经分析测得其中铜含量已经达标。
(1)在 pH=1.0 的废水中,氨氮的主要存在形式是_____(用化学式表示)。
(2)①加入废铁屑后,废水中的铜含量明显减少,反应的离子方程式是_____
②加入焦炭可以加快反应速率,原因是_________________________________
(3)结合化学用语解释加入 FeS 固体使废水达标的原因_________________________。
(4)在处理废水过程中使用的铁粉会因表面布满一层铜膜而失效,因此要对失效的铁粉进行活化处理,同时回收铜。处理方法为:用一定浓度的氨水浸泡包覆铜膜的铁粉,露置在空气中一段时间后,可以将表面的 Cu 转化为[Cu(NH3)4]2+与铁粉分离。
请写出 Cu 转化为 [Cu(NH3)4]2+的离子方程式:_____。
Ⅱ为研究废水处理的最佳 pH,取五份等量的 I 中上清液, 分别用 30%的 NaOH 溶液调节 pH 值至 8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量。实验结果如图所示。查阅资料可知:Cu(OH)2 + 4NH3![]() [Cu(NH3)4]2+ + 2OH-。
[Cu(NH3)4]2+ + 2OH-。
(5)根据实验结果,你认为最佳的 pH 约为_____________________________。结合资料解释实验结果呈图中 b~d 段曲线所示的原因:_________________________。

【题目】Ⅰ.中和滴定
(1)用酸式滴定管量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L-1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
该盐酸的浓度约为_____________(保留两位有效数字)。滴定达到终点的标志是_____________。
(2)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A. 滴定终点读数时俯视读数
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E. 配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F. 碱式滴定管尖嘴部分有气泡,滴定后消失
Ⅱ.(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
(2)然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的_______。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(3)常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为_______,Fe3+完全沉淀时溶液的pH为________(已知 lg5 = 0.7 )