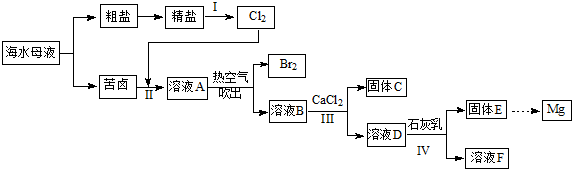
题目内容
2.下列说法正确的是( )| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | 已知单质A能从溶液中置换出单质B,当A为非金属时,B也一定是非金属 | |
| C. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| D. | 同周期非金属元素氧化物对应水化物的酸性从左到右依次增强 |
分析 A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
B.非金属性强的能置换非金属性弱的;
C.应为同周期ⅠA族元素的金属性比ⅡA族元素的金属性强;
D.同周期非金属元素最高价氧化物对应水化物的酸性从左到右依次增强.
解答 解:A.第三周期中阳离子比阴离子少一个电子层,电子层越多离子半径越大,阴离子半径大于阳离子半径,阳离子电子层结构相同,阴离子电子层结构相同,核电荷数越大离子半径越小,阳离子半径自左而右减小,阴离子半径自左而右减小,故A错误;
B.非金属性强的能置换非金属性弱的,已知单质A能从溶液中置换出单质B,当A为非金属时,B也一定是非金属,故B正确;
C.应为同周期ⅠA族元素的金属性比ⅡA族元素的金属性强,不是同周期则不一定,如金属性Ca>Na,故C错误;
D.同周期非金属元素最高价氧化物对应水化物的酸性从左到右依次增,不是最高价不能比较,故D错误,
故选B.
点评 本题考查原子结构与元素周期律,注意对元素周期律的理解掌握,难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
14.短周期主族元素X、Y、Z、W、Q的原子序数依次增大,Y原子的核外电子数是内层电子的4倍,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法不正确的是( )
| A. | 元素Q的最高价氧化物对应的水化物酸性比W的强 | |
| B. | 化合物W2Q2中,各原子最外层均达8电子结构 | |
| C. | 工业上通过电解Z与Q形成的化合物制备Z单质 | |
| D. | Y单质与X的气态氢化物可发生置换反应 |
12.设nA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1L 1 mol•L-1盐酸中含有nA个HCl分子 | |
| B. | 32g O2与O3的混合物含有2nA个氧原子 | |
| C. | 1L 1 mol•L-1CuCl2溶液中含有nA个Cu2+ | |
| D. | 1mol Na与足量Cl2反应,转移2nA个电子 |
19.下列解释实验事实的方程式不正确的是( )
| A. | 工业上用氧化铝冶炼金属铝:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑ | |
| B. | 工业上用过量的NaOH溶液吸收SO2:SO2+OH-=HSO${\;}_{3}^{-}$ | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO${\;}_{2}^{-}$+H2O | |
| D. | 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2CO2 |

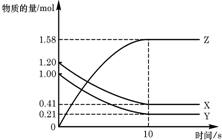 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题: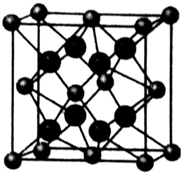 (1)K4[Fe(CN)6]中Fe2+与CN-两种离子之间的作用力是配位键,基态Fe2+的电子排布式1s22s22p63s23p63d6 或[Ar]3d6 ,1molCN-中含有π键的数目为2NA.
(1)K4[Fe(CN)6]中Fe2+与CN-两种离子之间的作用力是配位键,基态Fe2+的电子排布式1s22s22p63s23p63d6 或[Ar]3d6 ,1molCN-中含有π键的数目为2NA.