题目内容
7.下列离子方程式正确的是( )| A. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 向明矾溶液中加过量氢氧化钠溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
分析 A.一水合氨在离子反应中保留化学式;
B.电子不守恒;
B.NaOH过量,反应生成偏铝酸根离子;
D.硝酸过量,生成硝酸铁、NO和水.
解答 解:A.氯化镁溶液与氨水反应的离子反应为Mg2++2NH3.H2O═Mg(OH)2↓+2NH4+,故A错误;
B.Na2O2与H2O反应制备O2的离子反应为2Na2O2+2H2O═4Na++4OH-+O2↑,故B错误;
C.向明矾溶液中加过量氢氧化钠溶液的离子反应为Al3++4OH-═AlO2-+2H2O,故C正确;
D.向稀硝酸中加入少量铁粉的离子反应为Fe+4H++NO3-═Fe3++NO↑+2H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
19.下列解释实验事实的方程式不正确的是( )
| A. | 工业上用氧化铝冶炼金属铝:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑ | |
| B. | 工业上用过量的NaOH溶液吸收SO2:SO2+OH-=HSO${\;}_{3}^{-}$ | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO${\;}_{2}^{-}$+H2O | |
| D. | 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2CO2 |
18.有机物分子中原子(或原子团)间的相互影响会导致化学性质的不同.下列叙述不符合上述观点的是( )
| A. | 苯酚能与NaOH溶液反应,而乙醇不能 | |
| B. | 甲苯能够使酸性KMnO4溶液褪色,而苯不能 | |
| C. | 相等物质的量的甘油和乙醇分别与足量金属钠反应,甘油产生的H2多 | |
| D. | 在催化剂作用下苯能与液溴反应,而苯酚与溴水反应不需要催化剂 |
15.柑橘中柠檬烯的结构可表示为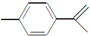 ,下列关于这种物质的说法中不正确的是( )
,下列关于这种物质的说法中不正确的是( )
 ,下列关于这种物质的说法中不正确的是( )
,下列关于这种物质的说法中不正确的是( )| A. | 该物质难溶于水 | |
| B. | 分子式为C10H14 | |
| C. | 既能发生取代反应,又能发生加成反应 | |
| D. | 既能使酸性高锰酸钾褪色又能使溴的四氯化碳溶液褪色 |
19.下列有机物命名正确的是( )
| A. | 3-甲基-1-戊烯 | B. | 3-甲基-2-乙基戊烷 | ||
| C. | 2,3-二甲基戊烯 | D. | 3,3-二甲基丁烷 |
16.下列变化过程中破坏化学键的是( )
| A. | 水加热汽化 | B. | 熔融氯化钠 | C. | 乙醇溶于水 | D. | 粉碎金刚石 |
17.下列各组中的反应,属于同一反应类型的是( )
| A. | 由2-溴丙烷制2-丙醇;由丙烯与水反应制丙醇 | |
| B. | 由甲苯制对硝基甲苯;由甲苯制苯甲酸 | |
| C. | 由氯代环己烷制环己烯;由丙烯与溴水反应制1,2-二溴丙烷 | |
| D. | 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯与水反应制苯甲酸和乙醇 |
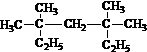 3,3,5,5-四甲基庚烷;
3,3,5,5-四甲基庚烷; ;
; ;
; .
.