题目内容
【题目】常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如图所示。下列叙述错误的是
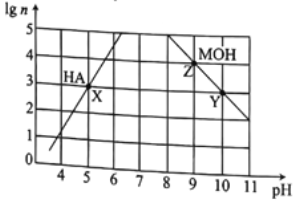
A. MOH为强碱,HA为弱酸
B. 水的电离程度:X=Y>Z
C. 若升高温度,Y、Z点对应溶液的pH值均减小
D. 将X点溶液与Z点溶液等体积混合,所得溶液中c(A-)>c(M+)>c(H+)>c(OH-)
【答案】B
【解析】A.lgn变化量与pH变化量相等时为强酸、强碱,故A正确;B.三个点均是抑制水的电离,酸中氢离子浓度越大、碱中氢氧根浓度越大,水的电离程度越弱,故X=Z>Y,故B错误;C.若升高温度,氢氧根离子浓度不变,Kw增大,所以氢离子浓度增大,对应溶液的pH值降低,故C正确;由于MOH为强碱、HA为弱酸,X点溶液的氢离子浓度与Z点溶液的氢氧根离子的浓度相等,等体积混合后,溶液显酸性,所得溶液中c(A-) > c(M+) > c(H+) > c(OH-),故D正确。

练习册系列答案
相关题目