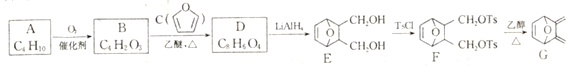
题目内容
【题目】勒夏特列原理往往适用于化学学科中的各种平衡理论,请回答下列问题:
(1)氯水可以杀菌消毒。氯水中存在多个平衡,含氯元素的化学平衡有__________个。氯水处理饮用水时,在夏季的杀菌效果比在冬季差,可能的原因是__________(一种原因即可)。在氯水中,下列关系正确的是_________(选填编号)。
a.c(H+)=c(ClO-)+c(Cl-) b.c(Cl-)=c(ClO-)+c(HClO) c.c(HClO)<c(Cl-) d.c(Cl-)<c(ClO-)
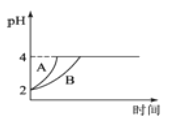
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示。则图中表示盐酸溶液中pH变化曲线的是__________(填“A”或“B”),反应开始时,产生H2的速率A__________B;加入足量Zn粒使酸均完全反应,产生H2的体积(相同状况下)A__________B(填“>”、“<”或“=”)
(3)难溶电解质在水溶液中存在溶解平衡,某MSO4溶液里c(M2+)=0.002mol·L-1,如果要将M2+完全转化成M(OH)2沉淀,应调整溶液pH的范围是______________[该温度下M(OH)2的Ksp=1×10-12,一般认为离子浓度≤1×10-5mol/L为完全沉淀]。
【答案】 3 温度较高时,HClO会分解或温度升高,氯气的溶解度减小 bc A = < ≥10.5
【解析】(1)氯气与水反应、HClO的电离及氯气的溶解均存在平衡;夏季温度高,HClO不稳定,光照分解;根据电荷守恒和物料守恒解答;
(2)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢,据此判断;
(3)根据溶度积常数计算。
(1)氯水中含氯元素的平衡关系为Cl2(aq)+H2O![]() HClO+H++Cl-、HClO
HClO+H++Cl-、HClO![]() H++ClO-、Cl2(g)
H++ClO-、Cl2(g)![]() Cl2(aq),即含氯元素的化学平衡有3个;夏季的杀菌效果比在冬季差,可能原因是夏季温度高,HClO易分解,杀菌效果比在冬季差;a.电荷守恒式为c(H+)=c(ClO-)+c(Cl-)+c(OH-),a错误;b.物料守恒为c(Cl-)=c(ClO-)+c(HClO),b正确;
Cl2(aq),即含氯元素的化学平衡有3个;夏季的杀菌效果比在冬季差,可能原因是夏季温度高,HClO易分解,杀菌效果比在冬季差;a.电荷守恒式为c(H+)=c(ClO-)+c(Cl-)+c(OH-),a错误;b.物料守恒为c(Cl-)=c(ClO-)+c(HClO),b正确;
c.由Cl2(aq)+H2O![]() HClO+H++Cl-、HClO
HClO+H++Cl-、HClO![]() H++ClO-可知,c(HClO)<c(Cl-),c正确;d.由Cl2(aq)+H2O
H++ClO-可知,c(HClO)<c(Cl-),c正确;d.由Cl2(aq)+H2O![]() HClO+H++Cl-、HClO
HClO+H++Cl-、HClO![]() H++ClO-可知,c(ClO-)<c(Cl-),d错误;答案选bc;
H++ClO-可知,c(ClO-)<c(Cl-),d错误;答案选bc;
(2)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,因此B曲线是醋酸溶液的pH变化曲线,则图中表示盐酸溶液中pH变化曲线的是A;反应开始时溶液中氢离子浓度相等,所以产生H2的速率A=B;由于醋酸的浓度大于盐酸的浓度,在溶液体积相等的条件下,加入足量Zn粒使酸均完全反应,醋酸产生H2多,即氢气的体积(相同状况下)A<B。
(3)离子浓度≤1×10-5mol/L为完全沉淀,则根据溶度积常数可知c(OH-)=![]() ,此时氢离子浓度是10-10.5mol/L,因此应调整溶液pH的范围是≥10.5。
,此时氢离子浓度是10-10.5mol/L,因此应调整溶液pH的范围是≥10.5。

【题目】某化学小组以铁为阳极,探究不同条件下阳极发生的电极反应。
实验装置 | 实验 | 电压 | 电解液 | 实验现象 |
| ⅰ | 3V | 3mol/LNa2SO4溶液 | 碳棒表面有大量气泡产生,溶液变黄,有红褐色沉淀产生 |
ⅱ | 3V | 3 mol/L KI溶液 | 碳棒表面有大量气泡产生,铁丝附近溶液变为棕色,逐渐变为棕褐色,约5min后,棕褐色消失,逐渐产生灰绿色絮状物 | |
ⅲ | 3V | 3mol/L NaOH溶液 | 两电极上都有大量气泡产生,5min后停止实验,取出铁丝,铁丝明显受腐,附有红棕色固体,溶液中未见沉淀物。 |
(1)①实验ⅰ中碳棒表面产生的气体是__________。
②实验ⅲ中铁丝上生成气体的电极反应式为__________。
③在实验ⅱ中,为验证铁丝电极的产物,取少量铁丝附近棕色溶液于试管中,滴加2滴K3Fe(CN)6溶液,无明显变化;另取少量铁丝附近棕色溶液检验发现溶液中有I2,检验方法是__________;对比实验ⅰ、ⅱ、ⅲ,可得出的结论是__________。
(2)为进一步探究增大c(OH-)对阳极反应的影响,该小组利用原装置做了实验ⅳ。
实验 | 电压 | 电解液 | 实验现象 |
ⅳ | 3V | 10 mol/L NaOH溶液 | 两电极上都有大量气泡产生,但碳棒上的速率远大于铁丝,且阳极区溶液逐渐变紫红色;停止实验,铁丝明显变细,电解液仍然澄清 |
查阅资料:FeO42-在溶液中呈紫红色。阳极电极反应式是__________。
(3)为探究实验ⅰ中溶液变黄的原因,该小组利用原装置做了实验ⅴ和ⅵ。
实验 | 电压 | 电解液 | 实验现象 |
ⅴ | 3V | 煮沸冷却的3 mol/L Na2SO4溶液 | 碳棒表面有大量气泡产生,铁丝外围包裹一层白色絮状沉淀,2min后表层变为褐色。 |
ⅵ | 8V | 煮沸冷却的3 mol/L Na2SO4溶液 | 碳棒表面迅速产生大量气泡,铁丝表面有气泡,1min后外围包裹一层白色絮状沉淀,2min后变绿,溶液中有红褐色悬浮物。 |
①实验ⅵ中白色絮状沉淀变为红褐色的反应化学方程式是__________。
②由此确定实验ⅰ中溶液变黄的原因是__________。
(4)综合上述实验,当铁为阳极时,影响电解过程中的阳极电极产物的因素有__________。