题目内容
2.A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A原子是D原子的2倍,D原子的最外层电子数是其次外层电子数的2倍,化合物B是造成温室效应的主要气体,F的浓溶液与A、D反应都有红棕色气体生成.则A原子的结构示意图为
 ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①和②均在水溶液中进行,写出反应②的离子方程式是2Fe2++Cl2═2Fe3++2Cl-,E与A再生成C的离子方程式是2Fe3++Fe═3Fe2+.
(3)请依据(2)中E与A的反应,设计一个原电池.要求:画出实验装置图(如图2),注明电解质溶液名称,正、负极及正负极材料,并标出电子移动方向,写出电极反应式.
正极反应式:2Fe3++2e-═2Fe2+;
负极反应式:Fe-2e-═Fe2+.
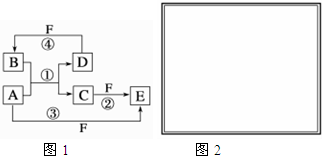
分析 (1)若A为短周期金属单质,D为短周期非金属单质,D原子的最外层电子数是其次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故D为碳,所含元素的原子序数A是D原子的2倍,则A原子序数是12,则A是Mg;化合物B是造成温室效应的主要气体,结合反应①可知B是CO2,C是MgO,F的浓溶液与A、D反应都有红棕色气体生成,则F是HNO3,E是Mg(NO3)2;
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行,D和F单质化合反应生成B为酸,由转化关系可知气体单质F能与A反应生成高价态化合物,则推断变价金属A为Fe,F为Cl2,D为H2,B为HCl,E为FeCl3;
(3)E与A发生反应:2Fe3++Fe═3Fe2+,石墨作正极,电极反应式为2Fe3++2e-═2Fe2+,Fe作负极,电极反应式为Fe-2e-═Fe2+,电解质溶液为FeCl3溶液,电子由负极流出,经导线流向正极.
解答 (1)若A为短周期金属单质,D为短周期非金属单质,D原子的最外层电子数是其次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故D为碳,所含元素的原子序数A是D原子的2倍,则A原子序数是12,则A是Mg;化合物B是造成温室效应的主要气体,结合反应①可知B是CO2,C是MgO,F的浓溶液与A、D反应都有红棕色气体生成,则F是HNO3,E是Mg(NO3)2,则:
A原子的结构示意图为: ,反应④的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
,反应④的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为: ;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行,D和F单质化合反应生成B为酸,由转化关系可知气体单质F能与A反应生成高价态化合物,则推断变价金属A为Fe,F为Cl2,D为H2,B为HCl,E为FeCl3,则:
反应②的离子方程式是:2Fe2++Cl2═2Fe3++2Cl-,E与A再生成C的离子方程式是:2Fe3++Fe═3Fe2+,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;2Fe3++Fe═3Fe2+;
(3)E与A发生反应:2Fe3++Fe═3Fe2+,石墨作正极,电极反应式为2Fe3++2e-═2Fe2+,Fe作负极,电极反应式为Fe-2e-═Fe2+,电解质溶液为FeCl3溶液,电子由负极流出,经导线流向正极,装置图为: ,
,
故答案为:2Fe3++2e-═2Fe2+;Fe-2e-═Fe2+; .
.
点评 本题考查无机物的推断、原电池设计等,涉及Fe、Mg、Cl、C、N元素化合物性质与转化,需要学生熟练掌握元素化合物性质,理解原电池工作原理,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
| A. | 该化合物化学式可表示为LiAlSi | |
| B. | 晶体中Al和Li构成CsCl型骨架 | |
| C. | 晶体中Al和Si构成金刚石型骨架 | |
| D. | 晶体中与每个Al距离最近的Li为4个 |
| A. | 燃烧反应都是放热反应 | |
| B. | 对于可逆反应:aA(g)+bB(g)?bC(g)+dD(g),如果正反应放热,逆反应一定吸热 | |
| C. | 氢气燃烧生成水是一个放热的化学反应,说明1mol H2的能量高于1mol H2O的能量 | |
| D. | 石墨转化为金刚石需要吸收能量,所以石墨的化学性质更稳定 |
(1)I2(g)+H2(g)?2HI(g)△H=-9.48 kJ•mol-1
(2)I2(s)+H2(g)?2HI(g)△H=+26.48 kJ•mol-1
下列判断正确的是( )
| A. | 254gI2( g)中通入 2gH2( g),反应放热 9.48 kJ | |
| B. | 1mol固态碘与1mol气态碘所含的能量相差17.00kJ | |
| C. | 反应(1)的产物比反应(2)的产物稳定 | |
| D. | 反应(2)的反应物总能量比反应(1)的反应物总能量低 |
| A. | CH4 | B. | C2H4 | C. | C2H2 | D. | CH3CH2CHO |
| A. | 参加反应的物质的性质是决定化学反应速率的主要因素 | |
| B. | 光是影响某些化学反应速率的外界条件之一 | |
| C. | 在给定条件下,当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 | |
| D. | 不管什么反应,增大浓度,或加热或加压,或使用催化剂,都可以加快反应速率 |

 .
. (只写一种).
(只写一种).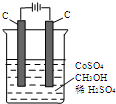 电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用如图装置模拟上述过程,则:
电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用如图装置模拟上述过程,则: