题目内容
7.据碘与氢气反应的热化学方程式(1)I2(g)+H2(g)?2HI(g)△H=-9.48 kJ•mol-1
(2)I2(s)+H2(g)?2HI(g)△H=+26.48 kJ•mol-1
下列判断正确的是( )
| A. | 254gI2( g)中通入 2gH2( g),反应放热 9.48 kJ | |
| B. | 1mol固态碘与1mol气态碘所含的能量相差17.00kJ | |
| C. | 反应(1)的产物比反应(2)的产物稳定 | |
| D. | 反应(2)的反应物总能量比反应(1)的反应物总能量低 |
分析 A.可逆反应,不能进行完全;
B.由盖斯定律知(2)-(1)计算判断;
C.都是HI的气态;
D.对于同一物质,固态物质的能量比气态物质能量低.
解答 解:A.因为是可逆反应,所以不能进行完全,放热小于9.48kJ,故A错误;
B.由盖斯定律知(2)-(1)得,9.48-(-26.48)=35.96kJ,故B错误;
C.一样稳定,都是HI的气态;故C错误;
D.对于同一物质,固态物质的能量比气态物质能量低,因此反应(2)的反应物总能量比反应(1)的反应物总能量低,故D正确;
故选:D.
点评 热化学方程式的书写一般是结合计算进行考查,所以应分两步:(1)写,特别注意注明各物质的状态,计量数可以是分数;(2)算,根据题意计算反应热;并注意盖斯定律在计算反应热中的应用来解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.某地污水中含有Zn2+、Hg2+、Fe3+、Cu2+四种阳离子.甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:
甲:污水$→_{①}^{+NaOH溶液,过滤}$沉淀$→_{②}^{△}$ CuO$→_{③}^{+H_{2}△}$ Cu
乙:污水$→_{①}^{+过量铁粉,过滤}$滤渣$→_{②}^{△}$CuO$→_{③}^{+H_{2}△}$ Cu
丙:污水$→_{①}^{+过量铁粉,过滤}$滤渣$→_{②}^{+稀盐酸,过滤}$滤渣$→_{③}^{△}$CuO$→_{④}^{+H_{2},△}$Cu
下列判断正确的是( )
甲:污水$→_{①}^{+NaOH溶液,过滤}$沉淀$→_{②}^{△}$ CuO$→_{③}^{+H_{2}△}$ Cu
乙:污水$→_{①}^{+过量铁粉,过滤}$滤渣$→_{②}^{△}$CuO$→_{③}^{+H_{2}△}$ Cu
丙:污水$→_{①}^{+过量铁粉,过滤}$滤渣$→_{②}^{+稀盐酸,过滤}$滤渣$→_{③}^{△}$CuO$→_{④}^{+H_{2},△}$Cu
下列判断正确的是( )
| A. | 三种实验方案都能制得纯净的铜 | |
| B. | 乙方案中加过量铁粉可以将四种阳离子全部还原 | |
| C. | 甲方案中的反应涉及置换、分解、化合、复分解四种反应类型 | |
| D. | 丙方案会产生环境污染 |
18.下列变化过程中肯定要放出热量的是( )
| A. | C+H20$\frac{\underline{\;\;△\;\;}}{\;}$C0+H2 | B. | H+ → → | ||
| C. | H20(1)→H20(g) | D. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ |
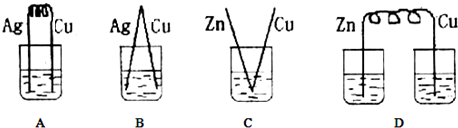
15.下列实验方案设计中,可行的是( )
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用萃取的方法分离汽油和煤油 | |
| C. | 将稀H2SO4与BaCl2的反应设计成原电池 | |
| D. | 将氢气和氧气的混合气体通过灼热的氧化铜,以除去其中的氢气 |
12.下列有关实验及操作的叙述中,不正确的是( )
| A. | 燃着的酒精灯打翻起火,应用水扑灭 | |
| B. | 如果苯酚溶液沾到皮肤上,应立即用酒精洗涤 | |
| C. | 向2 mL2% AgNO3溶液中滴加浓氨水至沉淀刚好消失制备银氨溶液 | |
| D. | 向新制的Cu(OH)2悬浊液中滴入少量乙醛溶液,加热,观察到红色沉淀 |
 ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
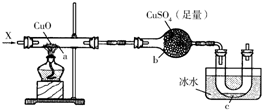 按照如图装置持续通入X气体或蒸气,可以看到a处有红色物质生成,b处变蓝,c处得到液体,(假设每个反应均完全)
按照如图装置持续通入X气体或蒸气,可以看到a处有红色物质生成,b处变蓝,c处得到液体,(假设每个反应均完全)