题目内容
【题目】(卷号)10000
(题号)2427322248593408
钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co2+的核外电子排布式为____,Co的第四电离能比Fe的第四电离能要小得多,原因是____。
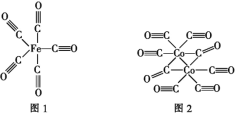
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1molFe(CO)5含有____mol配位键,图2中C原子的杂化方式为____,形成上述两种化合物的四种元素中电负性最大的是____(填元素符号)。
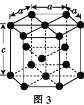
(3)金属钴的堆积方式为六方最密堆积,其配位数是____,钴晶体晶胞结构如图3所示,该晶胞中原子个数为____;该晶胞的边长为anm,高为cnm,该晶胞的密度为____(NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
【答案】![]() 或
或![]() Co失去三个电子后会变成
Co失去三个电子后会变成![]() ,更容易再失去一个电子形成半满状态
,更容易再失去一个电子形成半满状态![]() ,Fe失去三个电子后会变成
,Fe失去三个电子后会变成![]() ,达到半充满的稳定状态,更难再失去一个电子 10 sp、sp2 O 12 6
,达到半充满的稳定状态,更难再失去一个电子 10 sp、sp2 O 12 6 ![]()
【解析】
(1) Co 是27号元素,Co2+核外有25个电子;Co的第四电离能是失去3d6上的1个电子消耗的能量,Fe的第四电离能是失去3d5上的1个电子消耗的能量;
(2)CO分子中有1个配位键,铁原子与碳原子通过配位键结合;双键C原子的杂化方式为sp2、三键C原子的杂化方式为sp;元素非金属性越强电负性越大;
(3)六方最密堆积,原子配位数是12;利用“均摊原则”计算Co原子数;根据![]() 计算;
计算;
(1) Co2+核外有25个电子,核外电子排布式是![]() 或
或![]() ;原子轨道处于全满、半满、全空为稳定结构,Co失去三个电子后会变成
;原子轨道处于全满、半满、全空为稳定结构,Co失去三个电子后会变成![]() ,更容易再失去一个电子形成半满状态
,更容易再失去一个电子形成半满状态![]() ,Fe失去三个电子后会变成
,Fe失去三个电子后会变成![]() ,达到半充满的稳定状态,更难再失去一个电子;
,达到半充满的稳定状态,更难再失去一个电子;
(2)1个CO分子中有1个配位键,铁原子与碳原子通过配位键结合,所以1molFe(CO)5含有10mol配位键;双键C原子的杂化方式为sp2、三键C原子的杂化方式为sp,由图2可知,分子中既有三键C又有双键C,所以图2中C原子的杂化方式为sp、sp2;Fe、C、O、Co四种元素中,O元素非金属性最强,所以电负性最大的是O元素;
(3)金属钴的堆积方式为六方最密堆积,其配位数是12;利用“均摊原则”,Co原子数=![]() ;该晶胞的边长为anm,高为cnm,晶胞的体积为
;该晶胞的边长为anm,高为cnm,晶胞的体积为![]() ,该晶胞的密度为
,该晶胞的密度为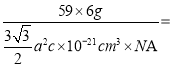
![]() g·cm-3。
g·cm-3。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O | K1=1.75×10-5mol·L-1 |
CH3COO-+H2O | K2=5.71×10-10mol·L-1 |
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大