题目内容
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
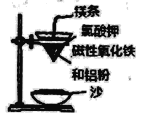
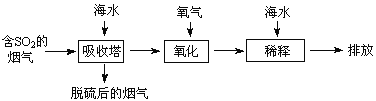
(l)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图)进行铝热反应,现象很壮观。使用镁条和氯酸钾的目的是___________。
(2)某同学取反应后的“铁块”和稀硝酸反应制备Fe(NO3)3溶液,其离子方程式为__________,溶液中可能含有Fe2+,其原因是___________;
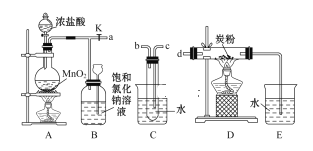
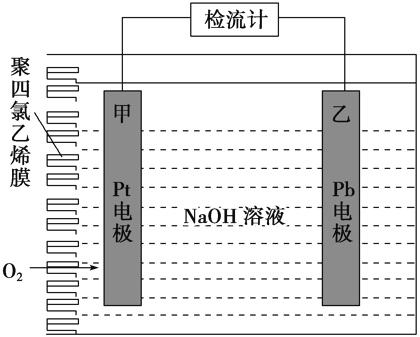
(3)可通过KClO溶液与Fe(NO3)3溶液的反应制备高铁酸钾(K2FeO4),如图所示是实验室模拟工业制备KClO溶液装置。已知氯气和热碱溶液反应生成氯化钾和氯酸钾和水

①盛装饱和食盐水的B装置作用为______________;
②反应时需将C装置置于冷水浴中,其原因为___________;
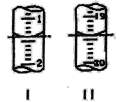
(4)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0 mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如图所示:
①终点II的读数为_______mL。
②原样品中高铁酸钾的质量分数为_________。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数_______(填“偏高”、“偏低”或“无影响”)。
【答案】引发铝热反应 Fe+4H++NO3-=Fe3++NO↑+2H2O 硝酸量不足2Fe3++Fe=3Fe2+ 吸收HCl 氯气在较高温度下与氢氧化钠反应生成KClO3 19.40 89.1% 偏低
【解析】
(1)铝热反应的条件是高温,使用镁条和氯酸钾的目的是引发铝热反应。
(3)“铁块”和稀硝酸反应制备Fe(NO3)3溶液,同时生成NO和水,其离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O,溶液中可能含有Fe2+,其原因是硝酸量不足,发生 2Fe3++Fe=3Fe2+;
(3)①浓盐酸具有挥发性,制得的氯气中混有HCl,盛装饱和食盐水的B装置作用为吸收HCl;
②实验要制取KClO,需防止温度升高后发生副反应生成KClO3,反应时需将C装置置于冷水浴中,其原因为氯气在较高温度下与氢氧化钠反应生成KClO3;
(4)①精确到0.01mL,终点II的读数为19.40mL。
②由图可知,起始和终点读数分别为1.40mL、19.40mL,则消耗Na2S2O3标准溶液的体积为18.00mL,由FeO42-~2I2~4Na2S2O3,可知原样品中高铁酸钾的质量分数为
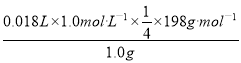 ×100%=89.1%,
×100%=89.1%,
③配制Na2S2O3标准溶液的过程中定容时俯视刻度线,体积偏小,标准液的浓度偏大,滴定时消耗标准液的体积偏小,则导致所测高铁酸钾的质量分数偏低.

 名校课堂系列答案
名校课堂系列答案【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa,②0.1mol·L-1NaClO,③0.1mol·L-1Na2CO3,④0.1mol·L-1NaHCO3溶液的pH由大到小的关系为_______________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为_______________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+=2HCOO-=2HCOOH+SO32-
D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(HO-)=10-ymol·L-1,x与y的关系如图所示。
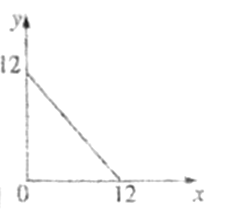
①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为____________。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性,写出按乙方式混合后,反应的离子方程式:______________。按甲方式混合后,所得溶液的pH为____________。