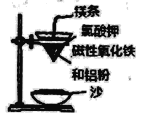
题目内容
【题目】手持技术的氧电化学传感器可用于测定O2含量,如图为某种氧电化学传感器的原理示意图。已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为a L(标准状况),某电极增重了b g。下列说法正确的是( )
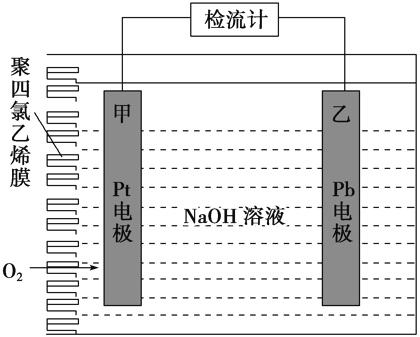
A.Pt上发生氧化反应
B.Pb上发生的电极反应式为Pb+2OH-+2e-=Pb(OH)2
C.反应过程中转移OH-的物质的量为0.25b mol
D.待测气体中氧气的体积分数为![]()
【答案】D
【解析】
在Pt电极,通入O2,得电子后与水结合成OH-,溶液质量的增加是由溶解氧引起的;在Pb电极,失电子生成的Pb2+与OH-结合,若附着在Pb电极上的固体为Pb(OH)2,则溶液的质量减轻,只有此固体为PbO时,才能满足“电解质溶液的质量保持不变”这一信息。故Pb电极生成PbO。
A. Pt电极上O2得电子发生还原反应,A不正确;
B. Pb上发生的电极反应式为Pb+2OH--2e-=PbO+H2O,B不正确;
C. 反应过程中转移OH-的物质的量为![]() ,C不正确;
,C不正确;
D. 待测气体中氧气的体积分数为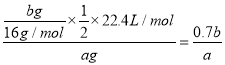 ,D正确。
,D正确。
故选D。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目