题目内容
【题目】根据所学知识完成题目:
(1)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O_____
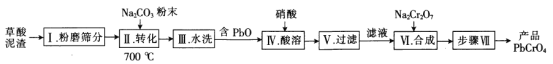
(2)钙元素是人体必需的常量元素,所有的细胞都需要钙元素.测定人体血液中钙元素的含量常用到如下两个反应:①CaC2O4+H2SO4=H2C204+CaSO4②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,上述反应②的还原剂是___;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂___mol,有__mol电子发生转移,相当于测出含钙元素的质量是__g。
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:_____。
【答案】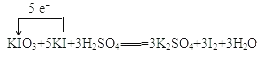 H2C2O4 4×10-4 2×10-3 0.04 2Fe(OH)3 + 3ClO- + 4OH- = 2FeO42- + 3Cl- + 5H2O
H2C2O4 4×10-4 2×10-3 0.04 2Fe(OH)3 + 3ClO- + 4OH- = 2FeO42- + 3Cl- + 5H2O
【解析】
(1) KIO3中碘化合价降低,KI中碘化合价升高,再分析转移电子数目。
(2)锰化合价降低,草酸中碳元素化合价升高,因此上述反应②的还原剂是草酸;若收集到44.8mL(标准状况)即物质的量为0.002mol的CO2时,根据方程式关系得到消耗氧化剂![]() ,根据方程式2mol高锰酸钾转移了10mol电子,有
,根据方程式2mol高锰酸钾转移了10mol电子,有![]() 电子发生转移,根据碳守恒得出草酸的物质的量为0.001mol,钙元素的物质的量等于草酸的物质的量,即测出含钙元素的质量。
电子发生转移,根据碳守恒得出草酸的物质的量为0.001mol,钙元素的物质的量等于草酸的物质的量,即测出含钙元素的质量。
(3)根据化合价分析,高铁酸钾由氢氧化铁升高得到,则次氯酸化合价降低得到氯离子,因此可以书写出碱性条件下制高铁酸钾的离子反应方程式。
(1) KIO3中碘化合价降低,KI中碘化合价升高,其电子转移表示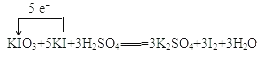 ,故答案为:
,故答案为: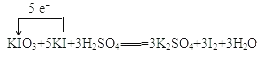 。
。
(2)②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,锰化合价降低,草酸中碳元素化合价升高,因此上述反应②的还原剂是草酸;若收集到44.8mL(标准状况)即物质的量为0.002mol的CO2时,根据方程式关系得到消耗氧化剂![]() ,根据方程式2mol高锰酸钾转移了10mol电子,若收集到44.8mL(标准状况)即物质的量为0.002mol的CO2时,有
,根据方程式2mol高锰酸钾转移了10mol电子,若收集到44.8mL(标准状况)即物质的量为0.002mol的CO2时,有![]() 电子发生转移,根据碳守恒得出草酸的物质的量为0.001mol,钙元素的物质的量等于草酸的物质的量,即测出含钙元素的质量是
电子发生转移,根据碳守恒得出草酸的物质的量为0.001mol,钙元素的物质的量等于草酸的物质的量,即测出含钙元素的质量是![]() ,故答案为:H2C2O4;4×10-4;2×10-3;0.04。
,故答案为:H2C2O4;4×10-4;2×10-3;0.04。
(3)根据化合价分析,高铁酸钾由氢氧化铁升高得到,则次氯酸化合价降低得到氯离子,因此碱性条件下制高铁酸钾的离子反应方程式2Fe(OH)3 + 3ClO + 4OH = 2FeO42 + 3Cl + 5H2O,故答案为:2Fe(OH)3 + 3ClO + 4OH = 2FeO42 + 3Cl + 5H2O。

【题目】在三个2 L恒容的容器中,分别发生反应A(g)+3B(g)![]() 2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是()
2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是()
反应前各物质的物质的量/mol
A | B | C | |
甲 | 1 | 3 | 0 |
乙 | 0 | 0 | 2 |
丙 | 1.5 | 4.5 | 1 |
A.乙中5min内C的反应速率为0.16mol-1·min-1
B.达到平衡时,丙中A的浓度是甲中的2倍
C.丙中反应的平衡常数大于甲中反应的平衡常数
D.达到平衡时,甲、乙两容器中C的物质的量相等