题目内容
【题目】如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。

(1)要将C装置接入B和D之间,正确的接法是a→________→________→________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为____________________。
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是____________________,B的作用是_______。
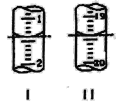
(4)用量筒量取20 mL E装置中溶液,倒入已检查完气密性良好的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上(如图),等分层后取上层液和下层液,呈黄绿色的是________(填“上层液”或“下层液”),再装入如图所示的烧杯中,能使有色布条褪色的是___(填“上层液”或“下层液”)。

(5)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并在方框中画出改进后的装置图:____________________。
【答案】c b d 2Cl2+C+2H2O![]() 4HCl+CO2 瓶中液面下降,长颈漏斗内液面上升 贮存少量Cl2,避免Cl2造成污染 下层液 上层液 D中反应生成的HCl气体极易溶于水,易使E装置中的溶液发生倒吸,改进后的E装置如图所示
4HCl+CO2 瓶中液面下降,长颈漏斗内液面上升 贮存少量Cl2,避免Cl2造成污染 下层液 上层液 D中反应生成的HCl气体极易溶于水,易使E装置中的溶液发生倒吸,改进后的E装置如图所示
【解析】
(1) 由装置图判断判断,气体由B流经C进入到D中反应,气体通过盛有水的试管时应长进短出,否则不能通过C装置,检验装置气密性时,可利用微热或加入水的方式形成压强差,观察长颈漏斗液面的变化来判断气密性,具体操作有两种方法:一是关闭K和A中分液漏斗的活塞,微热圆底烧瓶,B中长颈漏斗液面升高,停止加热后,长颈漏斗液面恢复至原位,则AB气密性良好;二是关闭K,往分液漏斗中不断加水至没过分液漏斗口,若B中长颈漏斗液面升高,且静置一段时间后高度保持不变,则AB气密性良好,要将C装置接入B和D之间,据以上分析解答;
(2) 由题意知反应为Cl2、C和H2O反应生成HCl和CO2,据此写出反应的化学方程式;
(3)由于余热的作用,A处仍有少量Cl2产生,B中的气体逐渐增多,压强增大,则导致瓶中液面下降,长颈漏斗内液面上升,氯气有毒,不能直接排放到空气中,据此分析B装置的作用;
(4) 氯气易溶于水,同时可与水反应生成盐酸和次氯酸, CCl4的密度比水大,分层后上层为水层,次氯酸下层为CCl4层,CCl4层溶有氯气呈黄绿色,水层中含有盐酸和次氯酸,次氯酸具有强氧化性,可使有色布条褪色,据以上分析解答;
(5) D中反应生成的HCl气体极易溶于水,易使E装置中的溶液发生倒吸,据此进行E装置的改装。
(1) 由装置图判断判断,气体由B流经C进入到D中反应,气体通过盛有水的试管时应长进短出,否则不能通过C装置,检验装置气密性时,可利用微热或加入水的方式形成压强差,观察长颈漏斗液面的变化来判断气密性,具体操作有两种方法:一是关闭K和A中分液漏斗的活塞,微热圆底烧瓶,B中长颈漏斗液面升高,停止加热后,长颈漏斗液面恢复至原位,则AB气密性良好;二是关闭K,往分液漏斗中不断加水至没过分液漏斗口,若B中长颈漏斗液面升高,且静置一段时间后高度保持不变,则AB气密性良好,要将C装置接入B和D之间,正确的接法是a→c→b→d,
答案为:c;b;d;
(2) 由题意知反应为Cl2、C、H2O,生成物为HCl和CO2,则反应的化学方程式为2Cl2+C+2H2O![]() 4HCl+CO2,
4HCl+CO2,
答案为:2Cl2+C+2H2O![]() 4HCl+CO2;
4HCl+CO2;
(3) 关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,B中的气体逐渐增多,压强增大,则导致瓶中液面下降,长颈漏斗内液面上升,氯气有毒,不能直接排放到空气中,B具有贮存少量氯气,并能防止空气污染,
故答案为:瓶中液面下降,长颈漏斗内液面上升;贮存少量Cl2,避免Cl2对环境造成污染;
(4) 氯气易溶于水,同时可与水反应生成盐酸和次氯酸, CCl4的密度比水大,分层后上层为水层,次氯酸下层为CCl4层,CCl4层溶有氯气呈黄绿色,水层中含有盐酸和次氯酸,次氯酸具有强氧化性,可使有色布条褪色;
答案为:下层液;上层液;
(5) D中反应生成的HCl气体极易溶于水,易使E装置中的溶液发生倒吸,改进后的E装置如图所示 ;
;
答案为:D中反应生成的HCl气体极易溶于水,易使E装置中的溶液发生倒吸,改进后的E装置如图所示 。
。