��Ŀ����
����Ŀ��ʵ������һδ֪Ũ�ȵ����ᣬijͬѧ��ʵ�����н���ʵ��ⶨ�����Ũ�ȡ������������գ�
����100mL0.10molL-1NaOH����Һ��ȡ20.00mL�������������ƿ�У��μ� 2~3�η�̪��ָʾ���������Ƶı� NaOH��Һ���еζ����ظ������ζ����� 2~3�Σ���¼�������£�
�ζ����� | ������������/mL | 0.10 mol/L NaOH ��Һ�����/mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
��һ�� | 20.00 | 2.00 | 28.15 |
�ڶ��� | 20.00 | 1.50 | 29.50 |
������ | 20.00 | 0.20 | 26.55 |
�ٸ�ʵ��ζ��ﵽ�յ�ı�־��____
�ڸ����������ݣ��ɼ�����������Ũ��ԼΪ___����������λ��Ч���֣�
��������ʵ���У����в���������������ȷ������ɲⶨ���ƫ�ߵ���____����˫ѡ��
A.�ζ��յ����ʱ���Ӷ���
B.��ʽ�ζ���ʹ��ǰ��ˮϴ��δ�ô���������ϴ
C.��ƿˮϴ��δ����
D.��ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ
E.����NaOH ����ʱ����������KOH����
����������ʵ�����Ƶ�0.10molL��1NaOH��Һ�ζ�δ֪Ũ�ȵ�CHCOOH��Һ����Ӧǡ����ȫʱ��������������ȷ����___
A.��Һ�����ԣ���ѡ�ü��Ȼ��̪��ָʾ��
B.��Һ�����ԣ�ֻ��ѡ��ʯ����ָʾ��
C.��Һ�ʼ��ԣ���ѡ�ü��Ȼ��̪��ָʾ��
D.��Һ�ʼ��ԣ�ֻ��ѡ�÷�̪��ָʾ��
���𰸡����������һ��NaOH��Һʱ����Һ����ɫǡ�ñ��dz��ɫ�������ڰ�����ڲ���ɫ 0.13molL-1 DE D
��������
������Һ��ɫ�仯�Ұ�����ڲ���ɫ����˵���ﵽ�ζ��յ㣻
�ڸ��ݵζ����ĵı�Һ������ж����ݵ���Ч�ԣ�Ȼ��������Һ��ƽ������������ݱ�c(����)=![]() ������������Ũ�ȣ�
������������Ũ�ȣ�
�۸���c(����)=![]() ��������������V��������Ӱ�죬�Դ��ж�Ũ�ȵ���
��������������V��������Ӱ�죬�Դ��ж�Ũ�ȵ���
�ܸ��������ˮ�⿼����Һ������ԣ�Ȼ�����ָʾ���ı�ɫ��Χ������кͺ��Խ�ӽ�Խ�ã��ұ�ɫ���ԡ�
�ٵζ�����ǰ�����е����̪����ҺΪ��ɫ���ζ�����ʱ�������ƹ�������Һ���dz��ɫ�����Եζ��յ�����Ϊ�����һ������������Һ���룬��Һ����ɫǡ�ñ��dz��ɫ���Ұ������dz��ɫ����ȥ��
�ʴ�Ϊ�����������һ��NaOH��Һʱ����Һ����ɫǡ�ñ��dz��ɫ�������ڰ�����ڲ���ɫ��
�ڵڶ����������ϴ�����ȥ�����ı�Һ��ƽ�����Ϊ��![]() mL =26.25 mL��
mL =26.25 mL��
�������Ũ��Ϊ��c��HCl��=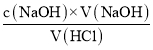 �T
�T![]() ��0.13molL-1��
��0.13molL-1��
�ʴ�Ϊ��0.13molL-1��
��A���ζ��յ����ʱ���Ӷ��������V������ƫС������c(����)=![]() ��������֪c(����)ƫС��
��������֪c(����)ƫС��
B����ʽ�ζ���ʹ��ǰ��ˮϴ��δ�ô���������ϴ������Һ��ϡ�ͣ������ʵ���ƫС�����V������ƫС������c(����)=![]() ��������֪c(����)ƫС��
��������֪c(����)ƫС��
C����ƿˮϴ��δ�������Һ�����ʵ������䣬��V��������Ӱ�죬����c(����)=![]() ��������֪c(����)���䣻
��������֪c(����)���䣻
D���ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ���������ʧ�����V������ƫ����c(����)=![]() ��������֪c(����)ƫ��
��������֪c(����)ƫ��
E. ����NaOH ����ʱ����������KOH���ʣ����Һ��Ũ�Ȼ�ƫС�����V������ƫ����c(����)=![]() ��������֪c(����)ƫ��
��������֪c(����)ƫ��
�ʴ�Ϊ��DE��
��ʵ���ҳ���3��ָʾ����pH��ɫ��Χ���£����ȣ�3.1��4.4�� ʯ�5.0��8.0�� ��̪��8.2��10.0��ʯ���ɫ�����ԣ�NaOH��Һ�κ�CH3COOH��Һ��Ӧǡ����ȫʱ��������CH3COONa��CH3COONaˮ����Һ�ʼ��ԣ�Ӧѡ����Է�Χ�ڱ�ɫ��ָʾ��������̪��D����ȷ���ʴ�Ϊ��D��

 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�����Ŀ��1��3������ϩ����Ҫ�Ļ���ԭ�ϣ���ҵ�ϳ���1-��ϩ������ķ����Ʊ�����0.lmol1����ϩ��0.675molˮ������ɵĻ��������80kPa��ѹ�½��з�Ӧ��CH3CH2CH=CH2(g)![]() CH2=CHCH=CH2(g)+H2(g)��H��
CH2=CHCH=CH2(g)+H2(g)��H��
��ش��������⣺
(1)��֪��ѧ�������������£��ɴ˼����H=____________kJmo1-1��
��ѧ�� | C��C | C=C | C��H | H��H |
����/kJmol-1 | 348 | 612 | 412 | 436 |
(2)��ͼ��ʾ���ⷴӦ���¶ȶ�1����ϩ��ƽ��ת���ʵ�Ӱ�죬��ҵ����ͨ�����Ʒ�Ӧ�¶�600�档
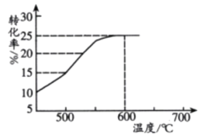
�������ҵ���������¶���600���ԭ��___________��
�ڴ��¶��·�Ӧ����2.5h��ﵽƽ�⣬�ӿ�ʼ��Ӧ������ƽ�⣬��H2��ʾ�ķ�Ӧ����Ϊv(H2)=_________kPah-1�����ⷴӦ��ƽ�ⳣ��Kp=_________kPa(KpΪ�Է�ѹ��ʾ��ƽ�ⳣ����p��=p�������ʵ�������)��
(3)���ܱ������з�Ӧ�ﵽƽ����ٳ���1.575mol1����ϩ��1.625mol1��3������ϩ����ѧ��Ӧ��_________(�����Ӧ�������淴Ӧ���ƶ���)������� ��