题目内容
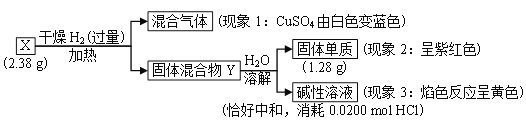
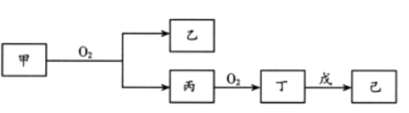
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。Z原子2p轨道上有3个未成对电子。甲、乙、丙、丁、戊是这四种元素之间形成的化合物,75%的甲溶液常用于消毒,戊是Z和X组成的10电子分子,常温下已溶液显中性,它们转化关系如图所示,则下列说法中错误的是
A.四种元素原子半径由大到小的顺序为:Y>Z>W>X
B.W的氢化物中的某一种具有漂白性
C.丙的电子式为![]()
D.W的氢化物沸点一定比Y的氢化物沸点高
【答案】D
【解析】
短周期主族元素X、Y、Z、W的原子序数依次增大,Z原子2p轨道上有3个未成对电子,是N,甲、乙、丙、丁、戊是这四种元素之间形成的化合物,75%的甲溶液常用于消毒,甲为乙醇,乙醇含有C、H、O元素,X为H,Y为C,W为O,乙醇可以和氧气反应生成乙醛和水,丙为乙醛,已为水,丙和氧气生成乙酸,丁为乙酸,戊是Z和X组成的10电子分子,为氨气,常温下已溶液显中性,为醋酸铵,X、Y、Z、W四种元素分别为H、C、N、O,然后分析。
A.X、Y、Z、W四种元素分别为H、C、N、O,同周期从左到右原子半径逐渐减小,原子半径由大到小的顺序为:Y>Z>W>X,故A正确;
B.W是O,它的氢化物中的某一种是过氧化氢,具有强氧化性,具有漂白性,故B正确;
C.丙是乙醛,分子中含有醛基,含有碳氧双键,电子式为![]() ,故C正确;
,故C正确;
D.W的氢化物可能为过氧化氢或过氧化氢,Y的氢化物可能为苯,过氧化氢或过氧化氢的沸点低于苯,故D错误;
答案选D。

【题目】实验室有一未知浓度的盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
配制100mL0.10molL-1NaOH标准溶液。取20.00mL待测盐酸放入锥形瓶中,滴加 2~3滴酚酞作指示剂,用配制的标准 NaOH溶液进行滴定。重复上述滴定操作 2~3次,记录数据如下:
滴定次数 | 待测盐酸的体积/mL | 0.10 mol/L NaOH 溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 20.00 | 2.00 | 28.15 |
第二次 | 20.00 | 1.50 | 29.50 |
第三次 | 20.00 | 0.20 | 26.55 |
①该实验滴定达到终点的标志是____
②根据上述数据,可计算出该盐酸的浓度约为___。(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有____。(双选)
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
E.称量NaOH 固体时,混入少量KOH杂质
④现用以上实验配制的0.10molL-1NaOH溶液滴定未知浓度的CHCOOH溶液,反应恰好完全时,下列叙述中正确的是___
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂