题目内容
【题目】 [实验化学]
3,4亚甲二氧基苯甲酸是一种用途广泛的有机合成中间体,微溶于水,实验室可用KMnO4氧化3,4亚甲二氧基苯甲醛制备,其反应方程式为

实验步骤如下:
步骤1:向反应瓶中加入3,4亚甲二氧基苯甲醛和水,快速搅拌,于70~80 ℃滴加KMnO4溶液。反应结束后,加入KOH溶液至碱性。
步骤2:趁热过滤,洗涤滤饼,合并滤液和洗涤液。
步骤3:对合并后的溶液进行处理。
步骤4:抽滤,洗涤,干燥,得3,4亚甲二氧基苯甲酸固体。
(1)步骤1中,反应结束后,若观察到反应液呈紫红色,需向溶液中滴加NaHSO3溶液,![]() 转化为_____________(填化学式);加入KOH溶液至碱性的目的是____________________________。
转化为_____________(填化学式);加入KOH溶液至碱性的目的是____________________________。
(2)步骤2中,趁热过滤除去的物质是__________________(填化学式)。
(3)步骤3中,处理合并后溶液的实验操作为__________________。
(4)步骤4中,抽滤所用的装置包括_______________、吸滤瓶、安全瓶和抽气泵。
【答案】[实验化学]
(1)SO42 将反应生成的酸转化为可溶性的盐
(2)MnO2
(3)向溶液中滴加盐酸至水层不再产生沉淀
(4)布氏漏斗
【解析】分析:(1)反应结束后,反应液呈紫红色,说明KMnO4过量,KMnO4具有强氧化性将HSO3-氧化成SO42-。根据中和反应原理,加入KOH将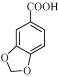 转化为可溶于水的
转化为可溶于水的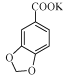 。
。
(2)MnO2难溶于水,步骤2中趁热过滤是减少 的溶解,步骤2中趁热过滤除去的物质是MnO2。
的溶解,步骤2中趁热过滤除去的物质是MnO2。
(3)步骤3中,合并后的滤液中主要成分为 ,为了制得
,为了制得 ,需要将合并后的溶液进行酸化。
,需要将合并后的溶液进行酸化。
(4)回忆抽滤装置即可作答。
详解:(1)反应结束后,反应液呈紫红色,说明KMnO4过量,KMnO4具有强氧化性将HSO3-氧化成SO42-,反应的离子方程式为2MnO4-+3HSO3-=2MnO2↓+3SO42-+H2O+H+。根据中和反应原理,加入KOH将 转化为可溶于水的
转化为可溶于水的 。
。
(2)MnO2难溶于水,步骤2中趁热过滤是减少 的溶解,步骤2中趁热过滤除去的物质是MnO2。
的溶解,步骤2中趁热过滤除去的物质是MnO2。
(3)步骤3中,合并后的滤液中主要成分为 ,为了制得
,为了制得 ,需要将合并后的溶液进行酸化;处理合并后溶液的实验操作为:向溶液中滴加盐酸至水层不再产生沉淀。
,需要将合并后的溶液进行酸化;处理合并后溶液的实验操作为:向溶液中滴加盐酸至水层不再产生沉淀。
(4)抽滤所用的装置包括布氏漏斗、吸滤瓶、安全瓶和抽气泵。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】N-苯基苯甲酰胺 广泛应用于药物,可由苯甲酸
广泛应用于药物,可由苯甲酸 与苯胺
与苯胺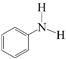 反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤-重结晶等,最终得到精制的成品。
反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤-重结晶等,最终得到精制的成品。
已知:
溶剂 物质 | 水 | 乙醇 | 乙醚 |
苯甲酸 | 微溶 | 易溶 | 易溶 |
苯胺 | 易溶 | 易溶 | 易溶 |
N-苯基苯甲酰胺 | 不溶 | 易溶于热乙醇,冷却后易于结晶析出 | 微溶 |
下列说法不正确的是
A. 反应时断键位置为C-O键和N-H键
B. 洗涤粗产品用水比用乙醚效果更好
C. 产物可选用乙醇作为溶剂进行重结晶提纯
D. 硅胶吸水,能使反应进行更完全