题目内容
【题目】下列反应属于同种物质中同一价态的同一元素部分被氧化,部分被还原的氧化还原反应的是( )
A.3Br2+6KOH![]() 5KBr+KBrO3+3H2O
5KBr+KBrO3+3H2O
B.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.2KNO3![]() 2KNO2+O2↑
2KNO2+O2↑
D.NH4NO3![]() N2O↑+2H2O
N2O↑+2H2O
【答案】A
【解析】
A、该反应中,部分Br由0价降为-1价,部分Br由0价升为+5价,A符合题意;
B、该反应中, Mn由+4价降为+2价, HCl中部分Cl由-1价升为0价,B不符合题意;
C、该反应中,N由+5价降为+3价,O 由-2价升为0价,C不符合题意;
D、该反应中,NH4+中的N全部由-3价升为+1价,NO3-中的N全部由+5价降为+1价,D不符合题意;
故选A。

【题目】实验室有一未知浓度的盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
配制100mL0.10molL-1NaOH标准溶液。取20.00mL待测盐酸放入锥形瓶中,滴加 2~3滴酚酞作指示剂,用配制的标准 NaOH溶液进行滴定。重复上述滴定操作 2~3次,记录数据如下:
滴定次数 | 待测盐酸的体积/mL | 0.10 mol/L NaOH 溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 20.00 | 2.00 | 28.15 |
第二次 | 20.00 | 1.50 | 29.50 |
第三次 | 20.00 | 0.20 | 26.55 |
①该实验滴定达到终点的标志是____
②根据上述数据,可计算出该盐酸的浓度约为___。(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有____。(双选)
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
E.称量NaOH 固体时,混入少量KOH杂质
④现用以上实验配制的0.10molL-1NaOH溶液滴定未知浓度的CHCOOH溶液,反应恰好完全时,下列叙述中正确的是___
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)在催化剂存在的条件下,用H2将NO还原为N2。已知:
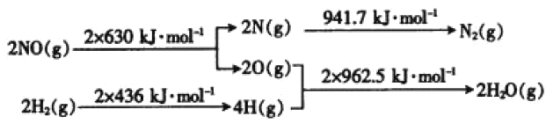
则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是_____。
(2)在500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g)在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
①反应进行到4min时,v(正)__v(逆) (填“>”“<”或“=”)。0~4min,H2的平均反应速率v(H2)=_mol·L-1·min-1。
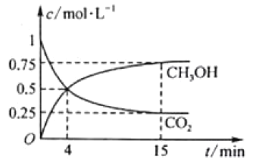
②CO2平衡时的体积分数为___,该温度下Kp为__(用含有p0的式子表示)。
③下列能说明该反应已达到平衡状态的是___。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1:3:1:1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
④500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器甲 | 容器乙 |
反应物起始投入量 | 1mol CO2,3mol H2 | 0.5mol CO2,1mol H2 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol ·L-1 | C1 | C2 |
则乙容器中反应起始向___方向进行;c1___c2。(填“>”“<”或“=”)
(3)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为___。