题目内容
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:
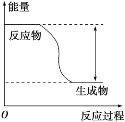
(1)该反应为_____(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率加快,下列措施可行的是_____(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_____(填“正”或“负”)极。铜片上的现象为_____,该极上发生的电极反应为_____,外电路中电子由_____移动。(填“正极向负极”或“负极向正极”)
【答案】放热 AC 正 有气泡产生 2H++2eˉ=H2↑ 负极向正极
【解析】
(1)该反应的反应物能量高于生成物能量,所以为放热反应;
(2)A.改铁片为铁粉可以增大反应物的接触面积,增大反应速率,故A符合题意;
B.常温下铁片在浓硫酸中发生钝化,且加热反应不产生氢气,故B不符合题意;
C.升高温度可以加快反应速率,故C符合题意;
(3)上述反应中Fe被氧化应为负极,则Cu为正极,电极反应为2H++2eˉ=H2↑,所以可以看到铜片上有气泡产生;外电路中电子由负极向正极移动。

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目