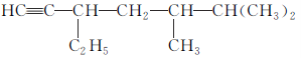题目内容
【题目】将一定量的Fe、Fe2O3和CuO的混合物,放入体积为100 mL物质的量浓度为2.2 mol/L的H2SO4溶液中,充分反应后,生成气体896mL(标准状况),得到不溶固体1.28 g。过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为100mL)。向滤液中加入2 mol/L NaOH溶液至40mL时开始出现沉淀。则未滴加NaOH溶液前滤液中FeSO4的物质的量浓度为
A. 1.8 mol/LB. 2 mol/LC. 2.2 mol/LD. 无法计算
【答案】A
【解析】
Fe、Fe2O3和CuO的混合物放入H2SO4溶液中充分反应后过滤,滤液中的金属离子只有Fe2+,发生的反应有Fe+H2SO4=FeSO4+H2↑、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、CuO+H2SO4=CuSO4+H2O、Fe+ Fe2(SO4)3=3FeSO4、Fe+CuSO4=FeSO4+Cu;滤液中加入2mol/LNaOH溶液至40mL时开始出现沉淀,说明与混合物反应后硫酸过量,所得滤液中含H2SO4和FeSO4,过量的硫酸物质的量为![]() ×2mol/L×0.04L=0.04mol;根据SO42-守恒,n(FeSO4)=2.2mol/L×0.1L-0.04mol=0.18mol,未滴加NaOH溶液前滤液中FeSO4物质的量浓度为0.18mol÷0.1L=1.8mol/L,答案选A。
×2mol/L×0.04L=0.04mol;根据SO42-守恒,n(FeSO4)=2.2mol/L×0.1L-0.04mol=0.18mol,未滴加NaOH溶液前滤液中FeSO4物质的量浓度为0.18mol÷0.1L=1.8mol/L,答案选A。

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目