题目内容
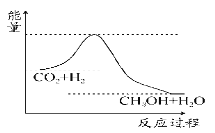
【题目】温室效应和资源短缺等问题和如何降低大气中的CO2含量并加以开发利用引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量 (单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量 (单位为kJ·mol-1)的变化。
(1)关于该反应的下列说法中,正确的是________。
A.ΔH>0,ΔS>0
B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0
D.ΔH<0,ΔS>0
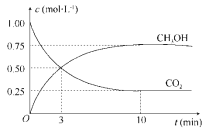
(2)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)____________________, CO2转化率为_________。相同温度下,某一时刻若该容器中含有1mol H2、1.2mol CO2、0.8 mol CH3OH、1.5mol H2O,则此时反应所处的状态为___________________________ (填“向正反应方向进行中”、 “向逆反应方向进行中”或“平衡状态”),理由______________________________________。
(3)在温度容积不变的条件下,能说明该反应已达平衡状态的是________(填写序号字母):
a.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
b.容器内压强保持不变
c.容器内的密度保持不变
d.H2的消耗速率与CH3OH的消耗速率之比为3∶1
(4)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是________(字母)。
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效的催化剂
【答案】C 0.225 mol·L-1·min-1 75% 向正反应方向进行中 QC= ![]() =1< K=5.33 bd c
=1< K=5.33 bd c
【解析】
(1)由图可知,反应物的总能量高于生成物的总能量,由反应方程式可知,该反应是一个熵减少的反应;
(2)由题给数据,运用反应速率公式和转化率公式计算;先计算化学平衡常数,再计算浓度熵,依据浓度熵和平衡常数的相对大小判断平衡移动方向;
(3)反应达到化学平衡状态时,正逆反应速率相等,各物质浓度或百分含量保持不变;
(4)该反应是一个气体体积减小的放热反应,依据化学平衡移动原理进行分析。
(1)由图可知,反应物的总能量高于生成物的总能量,该反应为放热反应,即△H<0,由反应方程式可知,该反应是一个熵减少的反应,即△S<0;故答案为:C;
(2)由图可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)=![]() =0.075mol/(Lmin),由反应速率之比等于化学计量数之比可得v(H2)=3v(CH3OH)=3×0.075mol/(Lmin)=0.225mol/(Lmin);由图可知,二氧化碳浓度的变化量为(1 mol/L—0.25mol/L)=0.75mol/L,则CO2转化率为
=0.075mol/(Lmin),由反应速率之比等于化学计量数之比可得v(H2)=3v(CH3OH)=3×0.075mol/(Lmin)=0.225mol/(Lmin);由图可知,二氧化碳浓度的变化量为(1 mol/L—0.25mol/L)=0.75mol/L,则CO2转化率为![]() ×100%=75%;平衡时甲醇的浓度为0.75mol/L,二氧化碳的浓度为0.25mol/L,氢气的浓度为(3mol/L—0.75mol/L×3)=0.75mol/L,水蒸气的浓度为0.75mol/L,化学平衡常数K为
×100%=75%;平衡时甲醇的浓度为0.75mol/L,二氧化碳的浓度为0.25mol/L,氢气的浓度为(3mol/L—0.75mol/L×3)=0.75mol/L,水蒸气的浓度为0.75mol/L,化学平衡常数K为![]() =
=![]() =5.33,某一时刻,1L该容器中含有1mol H2、1.2mol CO2、0.8 mol CH3OH、1.5mol H2O时,浓度熵QC=
=5.33,某一时刻,1L该容器中含有1mol H2、1.2mol CO2、0.8 mol CH3OH、1.5mol H2O时,浓度熵QC= ![]() =1< K=5.33,则平衡向正反应方向进行,故答案为:0.225 mol·L-1·min-1;75%;向正反应方向进行中;QC=
=1< K=5.33,则平衡向正反应方向进行,故答案为:0.225 mol·L-1·min-1;75%;向正反应方向进行中;QC= ![]() =1< K=5.33;
=1< K=5.33;
(3)a、n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1时,不能判断各组分的浓度是否不再变化,无法判断是否达到平衡状态,故错误;
b、该反应是一个体积体积减小的反应,容器内压强不变,说明正逆反应速率相等,反应达到平衡状态,故正确;
c、由质量守恒定律可知,平衡前后气体质量不变,反应过程中在温度容积不变的条件下,密度始终不变,所以容器内密度保持不变,无法判断是否达到平衡状态,故错误;
d、H2的消耗速率为正反应速率,CH3OH的消耗速率为逆反应速率,两者之比为3∶1说明正反应速率等于逆反应速率,反应达到平衡状态,故正确;
bd正确,故答案为:bd;
(4)a、及时分离出CH3OH气体,减小生成物的量,反应速率减小,平衡向正反应方向移动,故错误;
b、该反应是放热反应,升高温度,反应速率增大,平衡向逆反应方向移动,故错误;
c、该反应是气体体积减小的反应,保持容器的容积不变,再充入1molCO2和3molH2,相当于增大压强,反应速率增大,平衡向正反应方向移动,故正确;
d、选择高效的催化剂,反应速率增大,化学平衡不移动,故错误;
c正确,故答案为:c。

 阅读快车系列答案
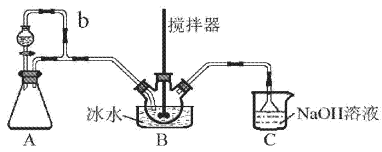
阅读快车系列答案【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
【题目】某兴趣小组为探究温度、压强对可逆反应A(g)+B(g) ![]() C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的量浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3]。请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的量浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3]。请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是
A | B | C | |
浓度1 | 0.05 mol·L-1 | a mol·L-1 | 0.05 mol·L-1 |
浓度2 | 0.078 mol·L-1 | 0.078 mol·L-1 | 0.022 mol·L-1 |
浓度3 | 0.06 mol·L-1 | 0.06 mol·L-1 | 0.04 mol·L-1 |
浓度4 | 0.07 mol·L-1 | 0.07 mol·L-1 | 0.098 mol·L-1 |
A. 由[浓度3]与[浓度1]的比较,可判断平衡移动的原因是增大了体系的压强
B. 由[浓度2]与[浓度1]的比较,可判断正反应是放热反应
C. [浓度1]中a=0.05
D. 该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4]。与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差
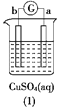
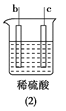
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是 ( )
|
|
|
|
a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()