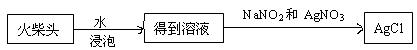
题目内容
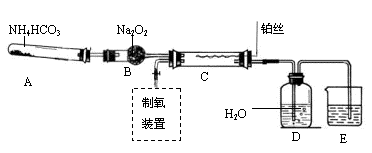
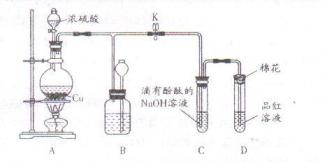
(6分)下图是某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器.铁架台.试管夹均未画出)。图中A处为无水乙醇(沸点78℃),B处为绕成螺旋状的细铜丝,C处为无水CuSO4粉末,D处为碱石灰,F处为新制的碱性Cu(OH)2悬浊液。
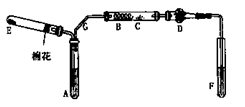
(1)在上述装置中,实验需要加热的仪器按加热的先后顺序排列为(填序号) 。
(2)为使A中乙醇平稳地汽化成乙醇蒸气,常用的方法是 。
(3)写出B处的现象 。

(1)在上述装置中,实验需要加热的仪器按加热的先后顺序排列为(填序号) 。
(2)为使A中乙醇平稳地汽化成乙醇蒸气,常用的方法是 。
(3)写出B处的现象 。
(6分)(1)B.E.A.F。(2)将试管A放入78℃的热水浴中。(3)铜丝的表面红色与黑色交替出现
乙醇催化氧化的实验原理:2CH3CH2OH+O2Cu/Ag△2CH3CHO+2H2O;所以
(1)加热的仪器先后顺序为:B、E、A、F,实验时应先加热铜丝使温度升高,再通入氧气生成氧化铜,再加热A产生乙醇蒸气;
(2)由于无水乙醇和沸点78℃比水低,为产生平稳的气流,常用水浴加热的方法加热。
(3)铜丝表面现象将会出现红、黑交替现象。其实质铜做为催化剂作用。
(1)加热的仪器先后顺序为:B、E、A、F,实验时应先加热铜丝使温度升高,再通入氧气生成氧化铜,再加热A产生乙醇蒸气;
(2)由于无水乙醇和沸点78℃比水低,为产生平稳的气流,常用水浴加热的方法加热。
(3)铜丝表面现象将会出现红、黑交替现象。其实质铜做为催化剂作用。

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
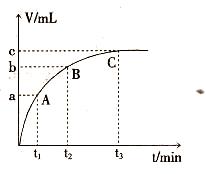
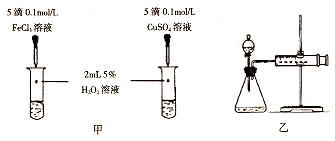
 l3溶液溶解Ag的反应更快更完全,请解释其原因:
l3溶液溶解Ag的反应更快更完全,请解释其原因: 
 直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。
直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。
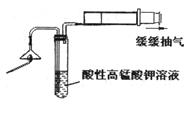
 关的两个主要反应的方程式是 ,
关的两个主要反应的方程式是 ,