题目内容
为了研究外界条件对H2O2分解速率的影响,某同学做了以下实验,请回答下列问题。
(1)过氧化氢分解的化学方程式为________。
(2)实验①的目的是________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_______(用实验中所提供的几种试剂)。
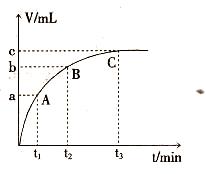
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最快的是______(填“A”或“B”或“C”)。
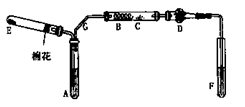
(5)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
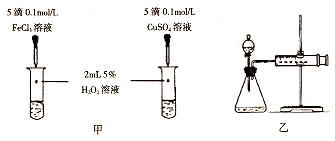
①定性分析:如图甲可通过观察_________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______。
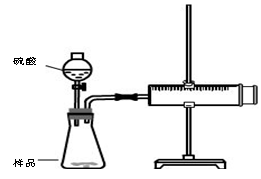
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_________。
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5%H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中。 | 试管A中产生气泡量减少;试管B中产生的气泡量增大。 |
| ② | 另取两支试管分别加入5mL 5%H2O2溶液和5mL 10%H2O2溶液 | 试管A、B中均未明显见到有气泡产生。 |
(2)实验①的目的是________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_______(用实验中所提供的几种试剂)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最快的是______(填“A”或“B”或“C”)。

(5)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

①定性分析:如图甲可通过观察_________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_________。
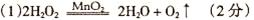
(2)研究温度对H2O2分解速率的影响 (2分)
(3)将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率(2分)
(4)A (1分)
(5)①溶液中气泡产生的速率 (1分)排除氯离子的干扰(其他合理答案也给分)(1分)
②收集40mL气体所需的时间(1分)(其它合理答案同样给分)
考查外界条件对反应速率的影响。
(1)过氧化氢在催化剂的作用下分解生成氧气和水,方程式为2H2O2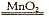 2H2O+O2↑。
2H2O+O2↑。
(2)根据实验过程中的操作可知,目的是研究温度对H2O2分解速率的影响。
(3)用于在实验中没有使用催化剂,且溶液的温度较低,双氧水的分解很慢,所以改进的方法是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率。
(4)反应速率越快,反映在曲线上的斜率就越大,所以根据图像可知,A点反应速率最快。
(5)①由于反应中产生氧气,所以可通过观察溶液中气泡产生的速率来比较反应快慢。由于两种盐溶液中阴离子特,所以为排除阴离子不同而造成实验的不准确,用硫酸铁最好。
②要想定量分析,则必须测量收集40mL气体所需的时间来比较反应的快慢。
(1)过氧化氢在催化剂的作用下分解生成氧气和水,方程式为2H2O2
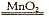 2H2O+O2↑。
2H2O+O2↑。(2)根据实验过程中的操作可知,目的是研究温度对H2O2分解速率的影响。
(3)用于在实验中没有使用催化剂,且溶液的温度较低,双氧水的分解很慢,所以改进的方法是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率。
(4)反应速率越快,反映在曲线上的斜率就越大,所以根据图像可知,A点反应速率最快。
(5)①由于反应中产生氧气,所以可通过观察溶液中气泡产生的速率来比较反应快慢。由于两种盐溶液中阴离子特,所以为排除阴离子不同而造成实验的不准确,用硫酸铁最好。
②要想定量分析,则必须测量收集40mL气体所需的时间来比较反应的快慢。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (CH3CH2CH2CH2)2O + H2O
(CH3CH2CH2CH2)2O + H2O  测定生成气体的体积
测定生成气体的体积