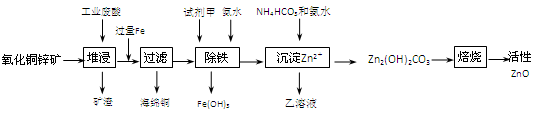
题目内容
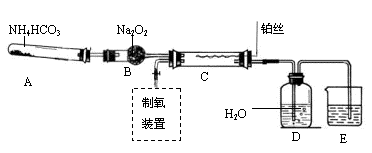
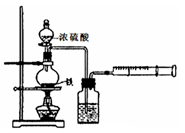
某化学探究学习小组设计如下图装置制取硝酸。(图中的夹持和加热仪器均已略去)
实验中可供使用的药品有:Na2CO3、NaHCO3、(NH4)2CO3、NH4HCO3、Na2O2、NaOH溶液、水。
请回答下列问题:
(1)装置C中发生反应的化学方程式是 。装置D中发生反应的化学方程式是 。
(2)撤去装置C中的加热装置后,铂丝仍然保持红热,这是因为: 。
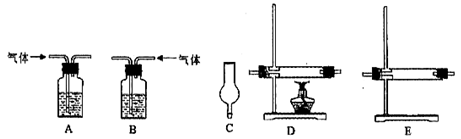
(3)实验过程中,要使NH4HCO3充分转化为HNO3,还要在装置C中通入氧气。利用上述药品制取氧气,可以选用下列装置中的 。(填序号)
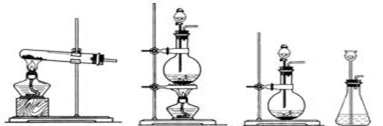
① ② ③ ④
(4)装置E中盛放的是 溶液,其作用是 。
(5)实验中,为了省略制氧气的装置,可以在A中再加入上述提供药品中的一种物质,它是 。
实验中可供使用的药品有:Na2CO3、NaHCO3、(NH4)2CO3、NH4HCO3、Na2O2、NaOH溶液、水。

请回答下列问题:
(1)装置C中发生反应的化学方程式是 。装置D中发生反应的化学方程式是 。
(2)撤去装置C中的加热装置后,铂丝仍然保持红热,这是因为: 。
(3)实验过程中,要使NH4HCO3充分转化为HNO3,还要在装置C中通入氧气。利用上述药品制取氧气,可以选用下列装置中的 。(填序号)

① ② ③ ④
(4)装置E中盛放的是 溶液,其作用是 。
(5)实验中,为了省略制氧气的装置,可以在A中再加入上述提供药品中的一种物质,它是 。
(1)4NH3 +5O2  4NO+6H2O
4NO+6H2O
4NO2+O2+4H2O=4HNO3
(2)氨的催化氧化是放热反应
(3)③
(4)NaOH;吸收可能未反应的氮氧化物,防止污染空气。
(5)NaHCO3
 4NO+6H2O
4NO+6H2O4NO2+O2+4H2O=4HNO3
(2)氨的催化氧化是放热反应
(3)③
(4)NaOH;吸收可能未反应的氮氧化物,防止污染空气。
(5)NaHCO3
观察所给装置可看出:
首先NH4HCO3分解:NH4HCO3=NH3↑+H2O↑+CO2↑
H2O与CO2可与Na2O2反应生成氧气:
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2NaCO3+O2↑
而氨气与氧气(可由制氧气装置补充氧气)在铂丝的催化作用下氧化生成NO:4NH3 +5O2 4NO+6H2O,2NO+O2=2NO2,4NO2+O2+4H2O=4HNO3
4NO+6H2O,2NO+O2=2NO2,4NO2+O2+4H2O=4HNO3
而氮的氧化物均对大气有污染,最终且碱液来吸收
(2)氨的催化氧化为放热反应,放出的热量足以保持反应的进行及维持铂丝的红热
(3)根据氧气的实验室制取原理及所给原料可知,可用过氧化钠与水反应得到氧气,属于固液不加热的反应类型,可选③装置;用分液漏斗来控制所需要的氨气的量
(4)只能选择NaHCO3,由于它分别可得到H2O与CO2,再与Na2O2反应可得到氧气,满足题意
首先NH4HCO3分解:NH4HCO3=NH3↑+H2O↑+CO2↑
H2O与CO2可与Na2O2反应生成氧气:
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2NaCO3+O2↑
而氨气与氧气(可由制氧气装置补充氧气)在铂丝的催化作用下氧化生成NO:4NH3 +5O2
 4NO+6H2O,2NO+O2=2NO2,4NO2+O2+4H2O=4HNO3
4NO+6H2O,2NO+O2=2NO2,4NO2+O2+4H2O=4HNO3而氮的氧化物均对大气有污染,最终且碱液来吸收
(2)氨的催化氧化为放热反应,放出的热量足以保持反应的进行及维持铂丝的红热
(3)根据氧气的实验室制取原理及所给原料可知,可用过氧化钠与水反应得到氧气,属于固液不加热的反应类型,可选③装置;用分液漏斗来控制所需要的氨气的量
(4)只能选择NaHCO3,由于它分别可得到H2O与CO2,再与Na2O2反应可得到氧气,满足题意

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目

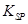 = 2.70×10-39]
= 2.70×10-39]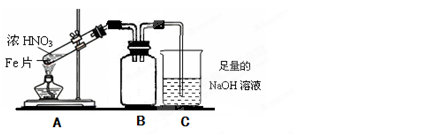


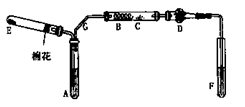
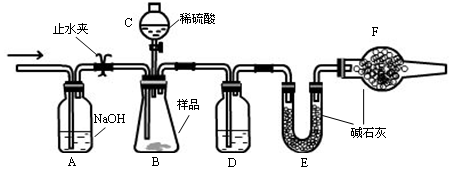
 了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。
了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。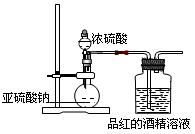
 3
3