题目内容
17.某Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质.现通过下列生产过程,从该样品中提纯Al2O3,并回收铁红.流程如图:
(1)操作①是过滤,在实验室进行该操作需要的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)试剂①是NaOH溶液,该反应的离子方程式是Al2O3+2OH-=2AlO2-+H2O.
(3)固体①加入适量稀盐酸,可能发生的反应有:Fe2O3+6H+=2Fe3++3H2O、Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+(用离子方程式表达).
(4)溶液③中铁元素的存在形式是Fe2+,如何用实验证明:取少量溶液,加入1滴KSCN溶液不显红色,再加入氯水,溶液变红,说明溶液中铁元素以Fe2+形式存在.
(5)溶液③中通入某气体,该气体可以是O2或Cl2(任写一种的化学式),红褐色固体制得铁红的化学方程式是2Fe(OH)3═Fe2O3+3H2O.
分析 Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质,根据题中流程图可知,样品与试剂①反应得溶液①再通入二氧化碳得白色沉淀,可推知试剂①为氢氧化钠,得到的固体①为Cu、Fe、Fe2O3,溶液①为偏铝酸钠溶液,通入过量二氧化碳后得溶液②为碳酸氢钠溶液,白色固体②为氢氧化铝,氢氧化铝受热分解得氧化铝,固体①中加入盐酸得固体粉末中铁有剩余,则溶液③中主要含有Fe2+,经过操作①得红褐色固体应为氢氧化铁,所以通入的气体应为氧化剂,可以是O2或Cl2,氢氧化铁受热分解得氧化铁,据此答题.
解答 解:Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质,根据题中流程图可知,样品与试剂①反应得溶液①再通入二氧化碳得白色沉淀,可推知试剂①为氢氧化钠,得到的固体①为Cu、Fe、Fe2O3,溶液①为偏铝酸钠溶液,通入过量二氧化碳后得溶液②为碳酸氢钠溶液,白色固体②为氢氧化铝,氢氧化铝受热分解得氧化铝,固体①中加入盐酸得固体粉末中铁有剩余,则溶液③中主要含有Fe2+,经过操作①得红褐色固体应为氢氧化铁,所以通入的气体应为氧化剂,可以是O2或Cl2,氢氧化铁受热分解得氧化铁,
(1)经过操作①得红褐色固体和溶液④,所以操作①应是过滤,过滤需要的玻璃仪器有烧杯、漏斗、玻璃棒,
故答案为:过滤;烧杯、漏斗、玻璃棒;
(2)根据上面的分析可知,试剂①是NaOH溶液,氧化铝与氢氧化钠反应的离子方程式是Al2O3+2OH-=2AlO2-+H2O,
故答案为:NaOH溶液;Al2O3+2OH-=2AlO2-+H2O;
(3)固体①为Cu、Fe、Fe2O3的混合物,固体①加入适量稀盐酸,可能发生的反应有Fe2O3+6H+=2Fe3++3H2O、Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+,
故答案为:Fe2O3+6H+=2Fe3++3H2O、Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;
(4)根据上面的分析可知,溶液③中铁元素的存在形式是Fe2+,用实验证明的方法是取少量溶液,加入1滴KSCN溶液不显红色,再加入氯水,溶液变红,说明溶液中铁元素以Fe2+形式存在,
故答案为:Fe2+;取少量溶液,加入1滴KSCN溶液不显红色,再加入氯水,溶液变红,说明溶液中铁元素以Fe2+形式存在;
(5)根据上面的分析可知,溶液③中通入某气体,该气体可以是O2或Cl2,红褐色固体为氢氧化铁,加热制得铁红为氧化铁,反应的化学方程为2Fe(OH)3═Fe2O3+3H2O,
故答案为:O2或Cl2;2Fe(OH)3═Fe2O3+3H2O.
点评 本题考查从Al2O3样品中提取氧化铝的工艺流程,题目难度中等,正确理解制备流程及反应原理为解答关键,注意掌握铝及其化合物性质,试题侧重考查学生的分析、理解能力及灵活应用所学知识的能力.

| A. | CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应 | |
| B. | 在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 | |
| C. | 物质燃烧都需要氧气 | |
| D. | 物质燃烧放出热最的多少与外界条件有关 |
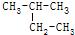 的烃,其正确的命名是( )
的烃,其正确的命名是( )| A. | 1,1-二甲基丙烷 | B. | 2-乙基丙烷 | C. | 3-甲基丁烷 | D. | 2-甲基丁烷 |
| A. | 雷雨时,可增加土壤中硝酸盐类氮肥的含量 | |
| B. | 许多领域中用液氮制得低温环境 | |
| C. | 造成光化学烟雾的罪魁祸首是SO2 | |
| D. | 正常雨水因溶有CO2,其pH约为5.6,而酸雨的pH小于5.6 |

| A. | 它可以使酸性KMnO4溶液褪色 | |
| B. | 它可以与银氨溶液反应 | |
| C. | 它可以使溴水褪色 | |
| D. | 它可被催化加氢,最后产物是C10H20O |
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 弱酸化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数(25℃) | 1.75×10-5 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
(1)物质的量浓度为0.1mol.L-1的下列4种物质,pH由大到小的顺序是A>B>D>C.
A.Na2CO3
B.NaClO
C.CH3COONa
D.NaHCO3
(2)若增大氯水中次氯酸的浓度,可向氯水中加入的物质是BD.
A.Na2CO3
B.NaClO
C.CH3COONa
D.NaHCO3
(3)常温下0.1mol.L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+).c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如下图所示,则HX的电离平衡常数大于(填“大于”“等于”或“小于”)醋酸的平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+)(填“大于”“等于”或“小于”).
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol/L.(填准确数值)


