题目内容
8.下面是几种实验中常用的仪器: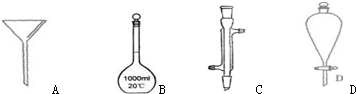
(1)写出序号所代表的仪器的名称:
B1000mL容量瓶;C冷凝管;D分液漏斗.
实验室要配制500mL 0.2mol/L NaOH溶液,请回答下列问题:
(2)配制过程中不需要使用的化学仪器有C(填选项的字母).
A.烧杯 B.500mL容量瓶 C.漏斗 D.胶头滴管 E.玻璃棒
(3)用托盘天平称取氢氧化钠,其质量为4.0g.
(4)该实验中两次用到玻璃棒,其作用分别是搅拌,加速溶解、引流.
(5)配制过程中,造成浓度偏低的操作可能有BCDE(选填下列操作的序号).
A、容量瓶蒸馏水洗后未加干燥
B、烧杯用蒸馏水洗后未干燥
C、将烧杯中NaOH移入容量瓶后,未用水洗涤烧杯,即向容量瓶中加水到刻度
D、用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线
E、定容时,仰视液面加水至刻度线.
分析 (1)根据仪器的图形判断仪器的名称;
(2)配制480mL溶液,需要选用500mL容量瓶,根据配制 500mL0.2mol/L NaOH溶液的步骤选择使用的仪器;
(3)根据n=cV计算出500mL0.2mol/L NaOH溶液中溶质的物质的量,再根据m=nM计算出氢氧化钠的质量;
(4)根据使用玻璃棒的操作来分析其用途;
(5)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)由仪器的图形可知A为漏斗,B为1000mL容量瓶,C为冷凝管,D为分液漏斗.
故答案为:1000mL容量瓶;冷凝管;分液漏斗;
(2)实验室要配制500mL 0.2mol/L NaOH溶液,配制步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,使用的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以不会使用的仪器为:C漏斗,
故答案为:C;
(3)500mL 0.2mol/L NaOH溶液中含有氢氧化钠的物质的量为:0.2mol/L×0.5L=0.1mol,需要氢氧化钠的质量为:40g/mol×0.1mol=4.0g,
故答案为:4.0;
(4)在配制过程中,溶解氢氧化钠固体时玻璃棒的用途是:搅拌,加速溶解;在移液时玻璃棒的用途是引流,故答案为:搅拌,加速溶解;引流;
(5)A、若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故A错误;
B、由于称量氢氧化钠固体要用烧杯,若烧杯用蒸馏水洗后未干燥,则称量出的氢氧化钠的实际质量会偏小,则配制出的溶液的浓度偏低,故B正确;
C、将烧杯中NaOH移入容量瓶后,未用水洗涤烧杯,会造成溶质的损失,则溶液浓度偏低,故C正确;
D、用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液,吸出的溶液中含有溶质,则会造成剩余的溶液的浓度偏低,故D选;
E、定容时,仰视液面加水至刻度线会造成溶液体积偏大,浓度偏低,故E正确.
故选BCDE.
点评 本题考查了一定物质的量浓度溶液的配制过程中涉及到的仪器的选择和使用以及误差分析等问题,难度不大.

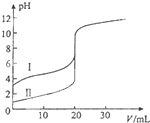
| A. | Ⅱ表示的是滴定醋酸的曲线 | |
| B. | V(NaOH)=20ml时,${C_{(C{l^-})}}$=${C_{(C{H_3}CO{O^-})}}$ | |
| C. | PH=7时,滴定醋酸消耗V(NaOH)小于20ml | |
| D. | V(NaOH)=10ml时,醋酸溶液中:${C_{(N{a^+})}}$>${C_{(C{H_3}CO{O^-})}}$>${C_{({H^+})}}$>${C_{(O{H^-})}}$ |
| A. | SiO2 CsCl CBr4 CF4 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | CF4 CBr4 CsCl SiO2 |
| A. | 阿司匹林 | B. | 氢氧化铝 | C. | 碘酒 | D. | 青霉素 |
| A. | 乙烯是石油裂解后的产物 | |
| B. | 芳香烃主要来自于煤的干馏后的煤焦油 | |
| C. | 汽油、煤油、柴油主要来自于石油的常压蒸馏 | |
| D. | 裂化汽油不能使溴水褪色 |
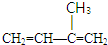 、
、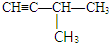 .
.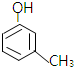 .
.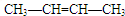 、
、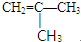 .
. 、
、
 ,如果要合成
,如果要合成 所用的原始原料可以是AC
所用的原始原料可以是AC