题目内容
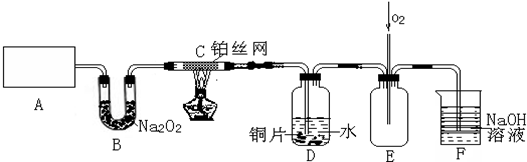
8.NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得.工艺流程如图甲:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有加热或搅拌或增大硫酸浓度等.(任写一点)
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式:Cu2++S2-═CuS↓.
(3)在40℃左右,用6%的H2O2氧化Fe2+,再在95℃时加入NaOH调节pH,除去铁和铬.此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去,其离子方程式为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O.如图乙是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域;若要在PH=2的条作下生成黄铁矾钠沉淀其温度范围为20~140℃.
(4)上述流程中滤液Ⅲ的主要成分是NiSO4、Na2SO4.
分析 废渣(除含镍外,还含有Cu、Zn、Fe、Cr等元素的化合物杂质),在硫酸溶解调节pH后过滤后除去铁离子,滤液含有二价铁离子、三价铬离子、铜离子、锌离子等杂质,滤液I中加入硫化钠形成CuS、ZnS沉淀,可除去铜离子、锌离子,过滤,滤液II中加H2O2是将二价铁氧化成三价铁,再通过调节pH使三价铁和三价铬都以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,主要是NiSO4,还有Na2SO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体,
(1)搅拌固体和液体的混合物,升高温度、增大浓度等,可加快反应速率;
(2)加Na2S,易生成CuS沉淀;
(3)用NaClO3与Fe2+发生氧化还原反应生成铁离子和氯离子,根据电荷守恒和元素守恒书写离子方程式,根据图象可判断在PH=2的条作下生成黄铁矾钠沉淀的温度范围;
(4)根据流程分析判断.
解答 解:废渣(除含镍外,还含有Cu、Zn、Fe、Cr等元素的化合物杂质),在硫酸溶解调节pH后过滤后除去铁离子,滤液含有二价铁离子、三价铬离子、铜离子、锌离子等杂质,滤液I中加入硫化钠形成CuS、ZnS沉淀,可除去铜离子、锌离子,过滤,滤液II中加H2O2是将二价铁氧化成三价铁,再通过调节pH使三价铁和三价铬都以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,主要是NiSO4,还有Na2SO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体;
(1)搅拌固体和液体的混合物,升高温度、增大浓度等,可加快反应速率,所以为了提高浸取率可采取的措施有加热或搅拌或增大硫酸浓度等;
故答案为:加热或搅拌或增大硫酸浓度等;
(2)加Na2S,易生成CuS沉淀,其反应的离子方程式为:Cu2++S2-═CuS↓,故答案为:Cu2++S2-═CuS↓;
(3)用NaClO3与Fe2+发生氧化还原反应生成铁离子和氯离子,反应的离子方程式为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,根据图象可判断在PH=2的条作下生成黄铁矾钠沉淀的温度范围是20~140℃,
故答案为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;20~140℃;
(4)由流程分析可知滤液Ⅲ的主要成分是NiSO4、Na2SO4,故答案为:NiSO4、Na2SO4.
点评 本题考查物质的分离提纯的实验方案的设计,为高考常见题型,侧重于学生的分析能力和实验能力的考查,题目难度较大,明确实验的目的和原理是解答该题的关键,注意把握基本实验操作.

 名校课堂系列答案
名校课堂系列答案| A. | 铝与Fe2O3发生铝热反应后固体物质增重 | |
| B. | Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到 | |
| C. | 过量的铜与浓硝酸反应可生成NO | |
| D. | 由于铝元素和铁元素都有+3价,由2Al+6HCl═2AlCl3+3H2↑可知:2Fe+6HCl═2FeCl3+3H2↑ |
| A. | 可能具有相同的密度 | B. | 可能具有相同的体积 | ||
| C. | 可能具有相同的氢原子数 | D. | 一定具有相同的电子数 |
| A. | 任何一种微观粒子的摩尔质量以g/moL为单位时,其数值与该种粒子的相对分子(或原子)质量相同 | |
| B. | 物质的量是含有一定粒子数目的粒子的集合体 | |
| C. | 阿伏加德罗常数个微粒数就是12g12C原子所含的碳原子数 | |
| D. | 物质的量就是物质的质量 |
| A. | 1mol任何气体的体积一定是22.4L | |
| B. | 在标准状况下,体积为22.4L的物质都是1mol | |
| C. | 标准状况下,22.4L任何气体所含分子数都约为6.02×1023个 | |
| D. | 在常温时,1mol任何气体的体积不可能是22.4L |
| A. | v(H2)=0.09 mol/(L•s) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.02 mol/(L•min) | D. | v(NH3)=0.03 mol/(L•s) |
| A. | H与D、16O与18O互为同位素,H216O、D216O、H218O、D218O互为同分异构体 | |
| B. | 金刚石、石墨均为碳的同素异形体,其化学性质与物理性质均不相同 | |
| C. | 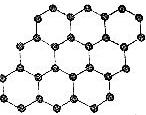 石墨烯(结构如图所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 | |
| D. | 由于氢原子可以形成H-(如NaH),所以有人建议可将氢元素排在元素周期表的ⅦA族 |