题目内容
16.下列说法不正确的是( )| A. | 任何一种微观粒子的摩尔质量以g/moL为单位时,其数值与该种粒子的相对分子(或原子)质量相同 | |
| B. | 物质的量是含有一定粒子数目的粒子的集合体 | |
| C. | 阿伏加德罗常数个微粒数就是12g12C原子所含的碳原子数 | |
| D. | 物质的量就是物质的质量 |
分析 A.以g/mol为单位时,摩尔质量在数值上等于该物质的相对分子质量或相对原子质量;
B.物质的量是表示微观粒子集合体的物理量;
C.12g碳-12所含的碳原子数就是阿伏加德罗常数;
D.物质的量与质量无关.
解答 解:A.以g/mol为单位时,摩尔质量在数值上等于该物质的相对分子质量或相对原子质量,故A正确;
B.物质的量是表示微观粒子集合体的物理量,物质的量是含有一定数目粒子的集合体,故B正确;
C.阿伏伽德罗常数的标准为:0.012kg12C中含有的碳原子数目,故C正确;
D.物质的量:表示含有一定数目粒子的集体,符号为n,单位是mol;质量:物体含有物质的多少叫质量,故D错误.
故选D.
点评 本题考查了物质的量、摩尔质量、质量以及阿伏加德罗常数概念的分析判断,掌握概念实质是关键,题目较简单.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
6.在某固定容积的密闭容器中存在化学平衡:aA(g)?bB(g)+C(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中错误的是( )
| A. | 若a=b+c时,B的物质的量分数不变 | B. | 若a<b+c时,A的转化率减小 | ||
| C. | 若a<b+c时,B的物质的量浓度减小 | D. | 若a>b+c时,A的物质的量分数减小 |
11.实验室中需要配制1mol/L的NaCl溶液970mL,配制时应选用的容量瓶的规格是( )
| A. | 950mL 容量瓶 | B. | 500mL容量瓶 | ||
| C. | 1000mL 容量瓶 | D. | 任意规格的容量瓶 |
5.以铬铁矿(主要成分是FeO•Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取Na2CrO4晶体的工艺流程如下:
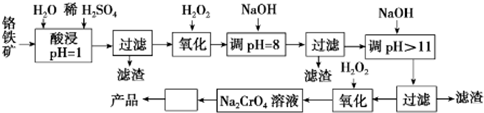
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO${\;}_{2}^{-}$形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)写出流程中第2次使用H2O2时,发生反应的离子方程式2Fe2++H2O2+2H+═2Fe3++2H2O;2CrO2-+3H2O2+2OH-═2CrO42-+4H2O.
(2)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?不能,当pH=8时Al3+已经完全转化为Al(OH)3,若不经过滤除去,当继续加入NaOH时Al(OH)3会溶解,引入杂质离子AlO2-.
(3)流程图中从Na2CrO4溶液至产品中间“□”内的操作是蒸发浓缩、冷却结晶.
(4)CrO42-在酸性条件下转化为Cr2O72-.工业上常用Fe2+处理酸性K2Cr2O7废水,先将Cr2O72-转化为Cr3+,该反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,再调节溶液的pH=9,使金属离子生成沉淀而除去.

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO${\;}_{2}^{-}$形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
(2)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?不能,当pH=8时Al3+已经完全转化为Al(OH)3,若不经过滤除去,当继续加入NaOH时Al(OH)3会溶解,引入杂质离子AlO2-.
(3)流程图中从Na2CrO4溶液至产品中间“□”内的操作是蒸发浓缩、冷却结晶.
(4)CrO42-在酸性条件下转化为Cr2O72-.工业上常用Fe2+处理酸性K2Cr2O7废水,先将Cr2O72-转化为Cr3+,该反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,再调节溶液的pH=9,使金属离子生成沉淀而除去.
6.在含有XCl2、YCl2、ZCl2和稀盐酸的混合溶液中逐渐加入锌粉,依次置换出的是Z、X、H2而得不到Y,则氧化性最强的离子是( )
| A. | Y2+ | B. | X2+ | C. | Z2+ | D. | H+ |
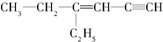 ,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8.
,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8.