题目内容
13.某化学兴趣小组在实验室探究氨的有关性质,设计了如图所示实验,A处是气体发生装置,A中所用的实验药品从下列物质中选取.①Na2CO3 ②NaOH ③Ca(OH)2 ④NaHCO3 ⑤NH4Cl
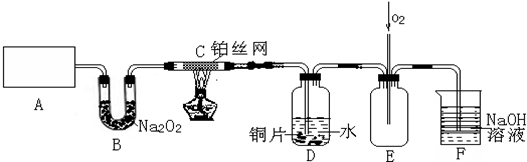
按如图连接好各仪器,现将C处的铂丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯.部分实验的现象如下:铂丝继续保持红热状态,D中的铜片慢慢溶解,回答下列问题:
(1)A中发生的化学反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.制取气体所用到的玻璃仪器主要有2种(不包括连接装置).
(2)B装置的作用为吸收二氧化碳和水蒸气并产生氧气.
(3)撤去C处酒精灯后铂丝能继续保持红热状态的原因是该反应是放热反应,为了使D中Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的BC(填下列各项序号)
A.Na2CO3 B.AgNO3 C.H2SO4 D.FeSO4
(4)图E中持续通入氧气的作用为将产生的NO氧化,充分被NaOH溶液吸收.
(5)有人认为他们设计的这套实验装置还存在明显的不足,对其不足之处以及应如何改进,谈谈你的意见:CD之间加一个防倒吸的装置.
分析 (1)实验室用加热氯化铵、氢氧化钙的方法制备氨气,反应为固体与液体加热,用到的玻璃仪器主要为试管和酒精灯;
(2)B装置作用是吸收二氧化碳和水蒸气生成氧气;
(3)放热反应开始后,不需要持续加热;硝酸根离子在酸性环境下具有强的氧化性能够氧化铜,增大氢离子浓度能使Cu片溶解的速率加快,可以加入试剂形成原电池加快反应速率,增大离子浓度加快反应速率;
(4)持续通入氧气使一氧化氮气体全部氧化,被氢氧化钠溶液吸收,减少环境污染;
(5)D装置中的液体易发生倒吸,需要在CD之间加一个防倒吸的装置.
解答 解:(1)加热氯化铵、氢氧化钙生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;反应为固体与液体加热,用到的玻璃仪器主要为试管和酒精灯;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;2;
(2)B装置是利用过氧化钠吸收碳酸氢钠分解生成的二氧化碳和水蒸气生成氧气,
故答案为:吸收二氧化碳和水蒸气并产生氧气;
(3)撤去C处酒精灯后铂丝能继续保持红热状态,说明该反应为放热反应;
A.Na2CO3 消耗硝酸不能加快铜的反应速率,故A错误;
B.AgNO3 和铜反应生成银,铜和银在稀硝酸溶液中析出原电池加快反应速率,故B正确;
C. H2SO4 会增大氢离子浓度加快铜与稀硝酸的反应速率,故C正确;
D.FeSO4会消耗硝酸,所以不能加快铜的反应速率,故D错误;
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;BC;
(4)持续通入氧气使一氧化氮气体全部氧化,被氢氧化钠溶液吸收,减少环境污染,故答案为:将产生的NO氧化,充分被NaOH溶液吸收;
(5)D装置中的液体易发生倒吸到C装置,需要在CD之间加一个防倒吸的装置,故答案为:CD之间加一个防倒吸的装置.
点评 本题考查了氨气的制备、性质的检验,熟悉氨气制备原理是解题关键,注意实验装置的作用和注意问题,题目难度中等.

LaNi5H6+6NiO(OH)$?_{充电}^{放电}$LaNi5+6Ni(OH)2
下列说法不正确的是( )
| A. | 反应过程中,化合价发生变化的元素是镍、镧 | |
| B. | 该电池放电时,负极反应为:LaNi5H6+6OH--6e-=LaNi5+6H2O | |
| C. | 市面上出售的标称容量为 2000 mA•h的1节镍氢电池至少应含有镧镍合金5.4 g(已知 1法拉第电量为96500库仑或安培•秒) | |
| D. | 充电电池放电后可以再充电使活性物质获得再生,但实际上充放电次数仍有限制 |

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO${\;}_{2}^{-}$形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
(2)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?不能,当pH=8时Al3+已经完全转化为Al(OH)3,若不经过滤除去,当继续加入NaOH时Al(OH)3会溶解,引入杂质离子AlO2-.
(3)流程图中从Na2CrO4溶液至产品中间“□”内的操作是蒸发浓缩、冷却结晶.
(4)CrO42-在酸性条件下转化为Cr2O72-.工业上常用Fe2+处理酸性K2Cr2O7废水,先将Cr2O72-转化为Cr3+,该反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,再调节溶液的pH=9,使金属离子生成沉淀而除去.
| A. | CH2=CH2+Cl2→CH2ClCH2Cl 加成反应 | |
| B. | 2CH3CHO+O2→2CH3COOH 加成反应 | |
| C. | CH3COOCH2CH3+H2O→CH3COOH+CH3CH2OH 取代反应 | |
| D. | C6H6+H2SO4→C6H5-SO3H+H2O 取代反应 |
| A. | 浓HCl | B. | 浓HN03 | C. | NaOH溶液 | D. | 稀HNO3 |

