题目内容
(12分)(1) 0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5千焦热量,其热化学方程式是:
。
又已知:H2O(液)=H2O(气);△H =-44kJ/mol,则11.2升(标准状况下)乙硼烷完全燃烧时生成气态水时放出的热量为 千焦。
(2)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态 水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。
水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
。
又已知:H2O(液)=H2O(气);△H =-44kJ/mol,则11.2升(标准状况下)乙硼烷完全燃烧时生成气态水时放出的热量为 千焦。
(2)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态
 水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。
水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
(12分)
(1)B2H6(g)+3O2(g)→B2O3(s)+3H2O(l) ΔH=–2165.0kJ·mol-1; 1016.5
(2)CH3OH(l)+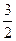 O2(g)→CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1
O2(g)→CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1
(3)N2(g)+3H2(g) === 2NH3(g) ΔH=-92kJ·mol-1
(1)B2H6(g)+3O2(g)→B2O3(s)+3H2O(l) ΔH=–2165.0kJ·mol-1; 1016.5
(2)CH3OH(l)+
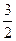 O2(g)→CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1
O2(g)→CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1(3)N2(g)+3H2(g) === 2NH3(g) ΔH=-92kJ·mol-1
略

练习册系列答案
相关题目

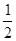 O2(g) = H2O(g) ΔH1=a kJ·mol-1
O2(g) = H2O(g) ΔH1=a kJ·mol-1 (g)+3H
(g)+3H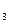 (g) △H= -92.4kJ/mol,则断裂 1 mol N≡N键需要吸收的热量为( )
(g) △H= -92.4kJ/mol,则断裂 1 mol N≡N键需要吸收的热量为( ) (g)+O2(g)===2CO2(g);ΔH=-566 kJ·mol-1
(g)+O2(g)===2CO2(g);ΔH=-566 kJ·mol-1 86 kJ·mol-1
86 kJ·mol-1 46 kJ·mol-1
46 kJ·mol-1 联氨(N2H4) 为燃料、过氧化氢为助燃剂。已知下列各物质反应的热化学方程式:
联氨(N2H4) 为燃料、过氧化氢为助燃剂。已知下列各物质反应的热化学方程式: