题目内容
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
| A.2H2(g)+O2(g) ="=" 2H2O(1)△H= ―285.8kJ/mol |
| B.2H2(g)+ O2(g) ="=" 2H2O(1)△H= +571.6 kJ/mol |
| C.2H2(g)+O2(g) ="=" 2H2O(g)△H= ―571.6 kJ/mol |
| D.H2(g)+1/2O2(g) ="=" H2O(1)△H= ―285.8kJ/mol |
D
2g氢气燃烧生成液态水,放出285.8kJ热量,即1mol氢气燃烧生成液态水,放出285.8kJ热量;所以
A错,热化学方程式中的化学计量数表示物质的量;B错,放热反应的反应为“—”;C错,生成水的状态为液态,不是气态;D正确;
A错,热化学方程式中的化学计量数表示物质的量;B错,放热反应的反应为“—”;C错,生成水的状态为液态,不是气态;D正确;

练习册系列答案
相关题目
 。
。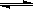 2SO3(g);△H =" a" kJ/mol,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
2SO3(g);△H =" a" kJ/mol,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
 水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。
水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。 O2(g)=H2O(l) △H3="-285.8KJ/mol "
O2(g)=H2O(l) △H3="-285.8KJ/mol "  是对环境影响较大的儿种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
是对环境影响较大的儿种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。 浓度的有__________ (选填字母)。
浓度的有__________ (选填字母)。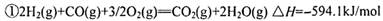

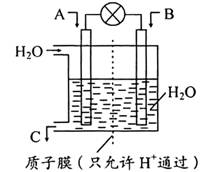
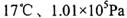 条件下,
条件下,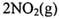
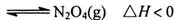 ,其平衡常数K=13.3。
,其平衡常数K=13.3。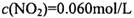 ,则
,则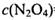 =_______________(保留两位有效数字)。
=_______________(保留两位有效数字)。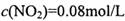 ,
, ,则改变的条件是____________________
,则改变的条件是____________________