题目内容
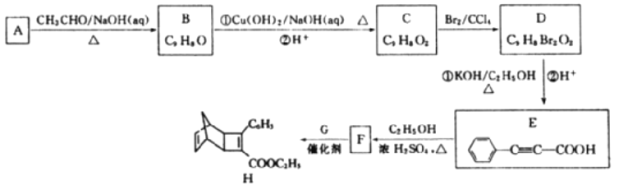
【题目】化合物H是一种有机光电材料的中间体。由芳香化合物A制备H的一种合成路线如下:
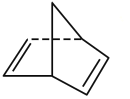
已知:①
②![]()
回答下列问题:
(1)A的化学名称是______________,E中含有的官能团的名称为______________。
(2)B的结构简式为______________,由D到E的反应类型为______________。
(3)由E生成F的化学方程式为______________________________。
(4)G的结构简式为____________________。
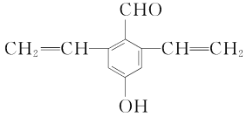
(5)同时满足下列条件的F的一种同分异构体的结构简式为____________________。
①与FeCl3溶液显紫色
②能发生银镜反应
③核磁共振氢谱为五组峰,峰面积比为4:2:2:1:1
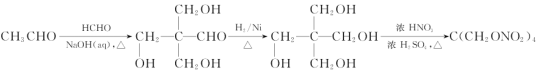
(6)设计由甲醛和乙醛为起始原料制备化合物C(CH2ONO2)4的合成路线:____________________(无机试剂任选)。
【答案】苯甲醛 碳碳三键、羧基 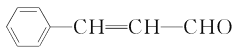 消去反应
消去反应 ![]()
 或
或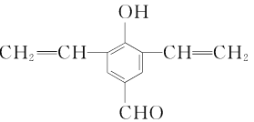
【解析】
由E的结构简式为![]() ,应用逆推法可知,D为
,应用逆推法可知,D为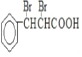 ,
,
 在氢氧化钠醇溶液中共热发生消去反应生成
在氢氧化钠醇溶液中共热发生消去反应生成![]() ;C为
;C为![]() ,
,![]() 与溴的四氯化碳溶液发生加成反应生成
与溴的四氯化碳溶液发生加成反应生成 ;B为
;B为![]() ,
,![]() 与新制的氢氧化铜反应后,酸化得到
与新制的氢氧化铜反应后,酸化得到![]() ;A为
;A为![]() ,
,![]() 与乙醛发生信息①反应生成
与乙醛发生信息①反应生成![]() ;
;
![]() 与乙醇在浓硫酸作用下共热发生酯化反应生成
与乙醇在浓硫酸作用下共热发生酯化反应生成![]() ,则F为
,则F为![]() ;
;![]() 与
与![]() 发生信息②反应生成
发生信息②反应生成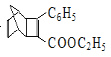 ,则C为
,则C为![]() 。
。
(1)A的结构简式为![]() ,名称为苯甲醛;E的结构简式为
,名称为苯甲醛;E的结构简式为![]() ,所含官能团为碳碳三键和羧基,故答案为:苯甲醛;碳碳三键和羧基;
,所含官能团为碳碳三键和羧基,故答案为:苯甲醛;碳碳三键和羧基;
(2)B的结构简式为![]() ;D到E的反应为
;D到E的反应为 在氢氧化钠醇溶液中共热发生消去反应生成
在氢氧化钠醇溶液中共热发生消去反应生成![]() ,故答案为:
,故答案为:![]() ;消去反应;
;消去反应;
(3)E生成F的反应为![]() 与乙醇在浓硫酸作用下共热发生酯化反应生成
与乙醇在浓硫酸作用下共热发生酯化反应生成![]() ,反应的化学方程式为
,反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)F为![]() ,其同分异构体与FeCl3溶液显紫色,说明含有酚羟基,能发生银镜反应,说明含有醛基,核磁共振氢谱为五组峰,峰面积比为4:2:2:1:1说明结构简式为
,其同分异构体与FeCl3溶液显紫色,说明含有酚羟基,能发生银镜反应,说明含有醛基,核磁共振氢谱为五组峰,峰面积比为4:2:2:1:1说明结构简式为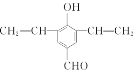 ,故答案为:
,故答案为: ;
;
(5)运用逆推法可知,甲醛和乙醛发生信息①反应生成 ,
, 与氢气在一定条件下发生加成反应生成
与氢气在一定条件下发生加成反应生成 ,
, 在浓硫酸作用下,与浓硝酸共热发生酯化反应生成C(CH2ONO2)4,则合成路线如下:
在浓硫酸作用下,与浓硝酸共热发生酯化反应生成C(CH2ONO2)4,则合成路线如下:
 ,故答案为:
,故答案为: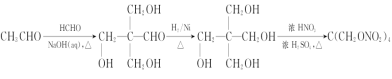 。
。