题目内容
【题目】氮化硼![]() 广泛应用于制造合金、耐高温材料和半导体。科研小组以富硼废料(主要成分为
广泛应用于制造合金、耐高温材料和半导体。科研小组以富硼废料(主要成分为![]() 和
和![]() ,还含有少量
,还含有少量![]() 等)为原料,制备氮化硼的一种工艺流程如下:
等)为原料,制备氮化硼的一种工艺流程如下:
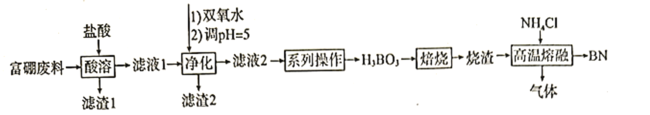
已知:硼酸溶于水和乙醇,在水中的溶解度如下
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度( | 2.77 | 4.78 | 8.90 | 14.89 | 23.54 | 39.60 |
回答下列问题:
(1)“酸溶”时需控制适当温度,温度不能过高的原因为____________________________;除控制适当温度外,可加快“酸溶”速率的措施还有__________________(答出一点即可)。
(2)“净化”时第一步反应的化学方程式为__________________;第二步调![]() 的目的为_______________;滤液2中
的目的为_______________;滤液2中![]() _______________(已知
_______________(已知![]() )
)
(3)“系列操作”中,洗涤结晶出来的硼酸的操作为__________________________。
(4)“高温熔融”过程中生成的气体为两种氢化物,则主要反应的化学方程式为__________________________;生成的气体用水吸收后可返回__________________________工序循环利用。
【答案】盐酸挥发使产率降低 搅拌、适当增大盐酸浓度等 2FeCl2+H2O2+2HCl=2FeCl3+2H2O 将Fe3+和Al3+完全转化为Al(OH)3、Fe(OH)3过滤除掉,而H3BO3保留在滤液中 1.3![]() 10-6mol/L 向过滤器中用玻璃棒引流加入0℃水至没过硼酸晶体,水自然流下,重复2~3次 B2O3+2NH4Cl
10-6mol/L 向过滤器中用玻璃棒引流加入0℃水至没过硼酸晶体,水自然流下,重复2~3次 B2O3+2NH4Cl ![]() 2BN+2HCl↑+3H2O 酸溶
2BN+2HCl↑+3H2O 酸溶
【解析】
富硼废料(主要成分为![]() 和
和![]() ,还含有少量
,还含有少量![]() 等)为原料,加入盐酸酸溶后得到滤渣1为
等)为原料,加入盐酸酸溶后得到滤渣1为![]() ,滤液1加入双氧水调节pH=5净化得到滤渣2为Al(OH)3、Fe(OH)3,过滤后得到滤液2通过一系列操作得到硼酸,硼酸焙烧后得到的烧渣主要为B2O3,与氯化铵高温熔融后制备氮化硼,同时生成氯化氢气体和水,据此分析。
,滤液1加入双氧水调节pH=5净化得到滤渣2为Al(OH)3、Fe(OH)3,过滤后得到滤液2通过一系列操作得到硼酸,硼酸焙烧后得到的烧渣主要为B2O3,与氯化铵高温熔融后制备氮化硼,同时生成氯化氢气体和水,据此分析。
(1)盐酸易挥发,故用盐酸进行“酸溶”时,温度过高,会导致盐酸挥发使产率降低。除控制适当温度外,可加快“酸溶”速率的措施可搅拌、适当增大盐酸浓度等;
(2)“净化”时第一步反应的目的是将FeCl2氧化为FeCl3,反应的化学方程式为2FeCl2+H2O2+2HCl=2FeCl3+2H2O;第二步调pH=5可将Fe3+和Al3+完全转化为Al(OH)3、Fe(OH)3过滤除掉,而H3BO3保留在滤液中;pH=5时,溶液中的c(OH-)=1![]() 10-9 mol/L,c(Al3+ )=
10-9 mol/L,c(Al3+ )= =
=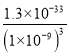 =1.3
=1.3![]() 10-6mol/L;
10-6mol/L;
(3)由信息知,硼酸冷水中溶解度低,为减少溶解损失,方法为向过滤器中用玻璃棒引流加入0℃水至没过硼酸晶体,水自然流下,重复2~3次;
(4) 硼酸焙烧后得到的烧渣主要为B2O3,“高温熔融”过程中B2O3与氯化铵反应生成的气体为HCl和水蒸气,则主要反应的化学方程式为B2O3+2NH4Cl ![]() 2BN+2HCl↑+3H2O;生成的气体用水回收后得盐酸,可返回到“酸溶”工序循环利用。
2BN+2HCl↑+3H2O;生成的气体用水回收后得盐酸,可返回到“酸溶”工序循环利用。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】在100℃时,将0.200 mol的四氧化二氮气体充入2 L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如下表格:
| 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应的化学方程式为N2O4![]() 2NO2 ,达到平衡时,四氧化二氮的转化率为__________%,表中c2________c3、a______b(填“>”、“<”或“=”)。
2NO2 ,达到平衡时,四氧化二氮的转化率为__________%,表中c2________c3、a______b(填“>”、“<”或“=”)。
(2) 20 s时四氧化二氮的浓度c1=________mol/L,在0 s~20 s时间段内,四氧化二氮的平均反应速率为________mol/(L·s)。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是________mol/L。
【题目】已知反应![]() 是可逆反应。设计如图装置(
是可逆反应。设计如图装置(![]() 均为石墨电极),分别进行下述操作:
均为石墨电极),分别进行下述操作:
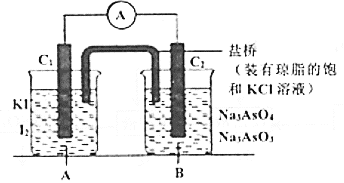
①向B烧杯中逐滴加入浓盐酸。②向B烧杯中逐滴加入![]() 溶液。结果发现电流表指针均发生偏转。
溶液。结果发现电流表指针均发生偏转。
(1)①过程中![]() 棒上发生的反应为_________;
棒上发生的反应为_________;
②过程中![]() 棒上发生的反应为___________。
棒上发生的反应为___________。
(2)操作②过程中,盐桥中的![]() 移向_________烧杯溶液(填“A”或“B”)。
移向_________烧杯溶液(填“A”或“B”)。
资料:![]() 。向
。向![]() 一定浓度的
一定浓度的![]() 溶液中加入
溶液中加入![]() 溶液,达平衡后,相关微粒浓度如下:
溶液,达平衡后,相关微粒浓度如下:
微粒 |
|
|
|
浓度 |
|
| a |
(3)a=________________。该平衡体系中除了含有![]() 和
和![]() 外,判断溶液是否一定还含有其他含碘微粒______________(填“是”或“否”)。
外,判断溶液是否一定还含有其他含碘微粒______________(填“是”或“否”)。
(4)已知:甲醇与水蒸气重整制氢可直接用于燃料电池。
反应:![]()
反应:![]()
则![]() ______________
______________![]()
(5)已知:25℃时,![]() 。医学上进行消化系统的X射线透视时,常使用
。医学上进行消化系统的X射线透视时,常使用![]() 作内服造影剂。胃酸酸性很强(pH约为1),但服用大量
作内服造影剂。胃酸酸性很强(pH约为1),但服用大量![]() 仍然是安全的,
仍然是安全的,![]() 不溶于酸的原因是(用溶解平衡原理解释):_________。误服少量
不溶于酸的原因是(用溶解平衡原理解释):_________。误服少量![]() ,应尽快用大量的一定浓度的
,应尽快用大量的一定浓度的![]() 溶液给患者洗胃,忽略洗胃过程中
溶液给患者洗胃,忽略洗胃过程中![]() 溶液浓度的变化,要使残留在胃液中的
溶液浓度的变化,要使残留在胃液中的![]() 浓度为
浓度为![]() ,应服用的
,应服用的![]() 溶液的最低浓度为_______
溶液的最低浓度为_______![]() 。
。
