题目内容
3.将4g NaOH溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度为0.1mol/L.分析 根据n=$\frac{m}{M}$计算4g NaOH的物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度,溶液是均一的,取出溶液、剩余溶液的浓度均与原溶液浓度相等.
解答 解:4g NaOH的物质的量为$\frac{4g}{40g/mol}$=0.1mol,解在10mL水中,再稀释成1L,稀释后NaOH溶液物质的量浓度为$\frac{0.1mol}{1L}$=0.1mol/L,溶液是均一的,取出10mL溶液与原溶液浓度相等,即从稀释后溶液中取出10mL溶液的物质的量浓度为0.1mol/L,
故答案为:0.1mol/L.
点评 本题考查物质的量浓度计算、溶液性质,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
13.丙酮和苯酚都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如图:
相关化合物的物理常数
回答下列问题:
(1)反应①和②分别在装置A和C中进行(填装置符号).
(2)反应②为放热(填“放热”或“吸热”)反应.反应温度控制在50-60℃,温度过高的安全隐患是温度过高会导致爆炸.
(3)在反应器A中通入的X是氧气或空气.
(4)在分解釜C中加入的Y为少量浓硫酸,其作用是催化剂,优点是用量少,缺点是腐蚀设备.
(5)中和釜D中加入的Z最适宜的是c(填编号.已知苯酚是一种弱酸)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚.
(7)用该方法合成苯酚和丙酮的优点是原子利用率高.

相关化合物的物理常数
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 苯酚 | 94 | 1.0722 | 182 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 异丙苯 | 120 | 0.8640 | 153 |
(1)反应①和②分别在装置A和C中进行(填装置符号).
(2)反应②为放热(填“放热”或“吸热”)反应.反应温度控制在50-60℃,温度过高的安全隐患是温度过高会导致爆炸.
(3)在反应器A中通入的X是氧气或空气.
(4)在分解釜C中加入的Y为少量浓硫酸,其作用是催化剂,优点是用量少,缺点是腐蚀设备.
(5)中和釜D中加入的Z最适宜的是c(填编号.已知苯酚是一种弱酸)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚.
(7)用该方法合成苯酚和丙酮的优点是原子利用率高.
14.三氯化磷(PCl3)是一种重要的有机合成催化剂.实验室常用红磷与干燥的Cl2制取PCl3,装置如图1所示.
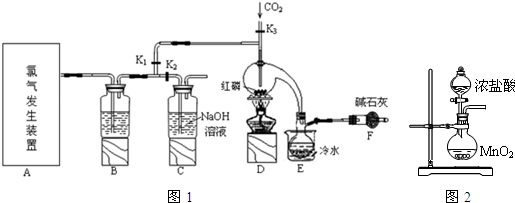
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见表.
请答下面问题:
(1)B中所装试剂是浓硫酸,F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应.
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行.通干燥CO2的作用是排尽装置中的空气,防止红磷自燃,
(3)实验制得的粗产品中常含有POCl3、PCl5等.加入红磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2.
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X.某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象.
(6)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把把玻璃管口用水润湿,然后稍稍用力即可把玻璃管插入橡皮管.甲同学将装置A的示意图画成图2,该示意图中明显的错误是没有(用酒精灯)加热.

已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)B中所装试剂是浓硫酸,F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应.
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行.通干燥CO2的作用是排尽装置中的空气,防止红磷自燃,
(3)实验制得的粗产品中常含有POCl3、PCl5等.加入红磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2.
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X.某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象.
| 实验步骤 | 实验现象 | 实验结论 |
| ① | 溶液X中含有Na+ | |
| ② | 溶液X中含有Cl- |
12.下列推断正确的是( )
| A. | NH3溶于水所得溶液能导电,据此可判断NH3属于电解质 | |
| B. | 某气体只含 N、H 两种元素,且质量之比为 14:3,则该气体一定为纯净物 | |
| C. | 氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应 | |
| D. | 尽管 NO2能与水反应生成硝酸,但 NO2不属于酸性氧化物 |
13.下列各组离子在无色溶液中能大量共存,且加入铝粉一定能放出氢气的是( )
| A. | Fe2+、Na+、H+、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ba2+、Na+、OH-、NO3- | D. | Na+、Mg2+、NO3-、OH- |
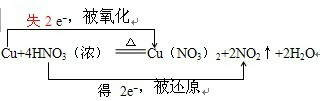 .
.