题目内容
11.下列说法正确的是( )| A. | HCHO溶液、(NH4)2SO4溶液均能使蛋白质变性 | |
| B. | 分子式为C2H4O2的有机物不一定是羧酸 | |
| C. | 煤的干馏是物理变化,煤的气化和液化是化学变化 | |
| D. | 纤维素、蛋白质、油脂、糖类在一定条件下都能发生水解反应 |
分析 A、蛋白质溶液中加入浓的硫酸铵溶液会使蛋白质盐析;
B、分子式为C2H4O2的有机物可以是酸,也可以是酯类;
C、煤的干馏是将煤隔绝空气加强热使其分解的过程;
D、葡萄糖不能发生水解反应.
解答 解:A、蛋白质溶液中加入浓的硫酸铵溶液会使蛋白质盐析,HCHO溶液能使蛋白质变性,故A错误;
B、分子式为C2H4O2的有机物可以是酸,也可以是酯类,故B正确;
C、煤的干馏是将煤隔绝空气加强热使其分解的过程,是化学变化,煤的气化和液化也是化学变化,故C错误;
D、葡萄糖是单糖,不能发生水解反应,故D错误.
故选B.
点评 本题是对有机物性质的考查,可以根据所学内容来回答,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.短周期非金属元素甲~戊在元素周期表中的相对位置如表所示,下面判断不正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 非金属性:乙>丁 | |
| C. | 最高价氧化物的水化物的酸性:丙<丁 | |
| D. | 最外层电子数:丙>丁>戊 |
2.纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液.放电时两个电极反应分别为:Zn+2OH-→Zn(OH)2+2e-Ag2O+H2O+2e-→2Ag+2OH- 下列说法中正确的是( )
| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 在电池放电的过程中,电解质溶液的碱性变大 |
19.下列反应的离子方程式正确的是( )
| A. | 氯气通入氢氧化钠溶液中 Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 金属铁与稀硝酸反应 Fe+2H+=Fe2++H2↑ | |
| C. | 在硅酸钠溶液中滴加稀硫酸 SiO32-+2H+=H2SO3↓ | |
| D. | 铜粉与98.3%的硫酸加热下反应 Cu+4H++SO42-=Cu2++SO2↑+2H2O |
16.某同学用如图所示装置制备并检验Cl2的性质.下列说法正确的是( )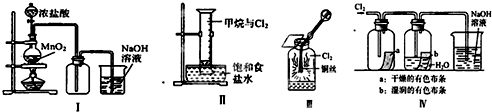

| A. | Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗 | |
| B. | Ⅱ图中:量筒中发生了加成反应 | |
| C. | Ⅲ图中:生成蓝色的烟 | |
| D. | Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
3.某同学想用实验证明高锰酸钾溶液的紫红色是MnO4-离子的颜色,而不是K+离子的颜色,他设计的下列实验步骤中没有意义的是( )
| A. | 将高锰酸钾晶体加热分解,所得固体质量减少 | |
| B. | 观察氯化钾溶液没有颜色,表明溶液中K+无色 | |
| C. | 在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+无反应 | |
| D. | 在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO4-离子为紫红色 |
20.某溶液中有NH4+、Ca2+、Mg2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中浓度变化最大的离子是( )
| A. | NH4+ | B. | Ca2+ | C. | Mg2+ | D. | Al3+ |
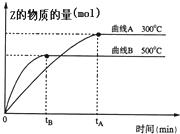 向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),不同温度下,测得平衡状态Z的物质的量变化曲线如图所示.
向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),不同温度下,测得平衡状态Z的物质的量变化曲线如图所示.