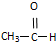题目内容
9.常温下,能促进水的电离的物质是( )| A. | 醋酸 | B. | NaOH溶液 | C. | Na2CO3溶液 | D. | 硫酸 |
分析 水的电离方程式为H2O?H++OH-,水电离出H+、OH-导致酸或碱抑制水电离,含有弱离子的盐促进水电离,据此分析解答.
解答 解:水的电离方程式为H2O?H++OH-,水电离出H+、OH-导致酸或碱抑制水电离,含有弱离子的盐促进水电离,
A.醋酸是酸,醋酸电离出氢离子而抑制水电离,故A不选;
B.NaOH是碱,NaOH电离出氢氧根离子而抑制水电离,故B不选;
C.碳酸钠是强碱弱酸盐,碳酸根离子水解而促进水电离,故C选;
D.硫酸是酸,硫酸电离出氢离子而抑制水电离,故D不选;
故选C.
点评 本题考查水的电离,明确哪些物质参加水电离、哪些物质抑制水电离是解本题关键,题目难度不大.

练习册系列答案
相关题目
19.一定条件下,卤代烃和金属钠能发生伍兹反应:R-X+2Na+R′-X→R-R′+2NaX,反应中有C-X键的断裂和C-C键的形成.据此,以下卤代烃伍兹反应的可能产物(不考虑NaX)及命名不合理的是( )
| A. | 一氯甲烷和2-氯丙烷:正丁烷 | |
| B. | 2,2-二甲基-1-氯丙烷与一氯甲烷:2,2-二甲基丁烷 | |
| C. | 1,5-二氯戊烷:环戊烷 | |
| D. | 一氯甲烷和四氯化碳:2,2-二甲基丙烷 |
17.下列属于链烃的是( )
| A. | CH3CH2Cl | B. | 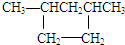 | C. | 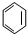 | D. | CH4 |
4.银锌电池广泛用作电子仪器的电源,它的充电和放电过程可表示为:
Ag2O+Zn+H2O$?_{充电}^{放电}$2Ag+Zn(OH)2.此电池放电时负极反应的生成物是( )
Ag2O+Zn+H2O$?_{充电}^{放电}$2Ag+Zn(OH)2.此电池放电时负极反应的生成物是( )
| A. | Ag | B. | Zn(OH)2 | C. | Ag2O | D. | Zn |
1.短周期非金属元素甲~戊在元素周期表中的相对位置如表所示,下面判断不正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 非金属性:乙>丁 | |
| C. | 最高价氧化物的水化物的酸性:丙<丁 | |
| D. | 最外层电子数:丙>丁>戊 |
18.如表为元素周期表中的一部分,列出11种元素在元素周期表中的位置.用化学符号回答下列各问题.
(1)11种元素中,第一电离能最小的是K;电负性最大的是F.(都用化学符号表示)
(2)④、⑤、⑥三种元素最高价氧化物对应的水化物中,呈两性的是Al(OH)3.(填化学式)
(3)元素②的氢化物的电子式为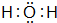 ;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
(4)④和⑦的最高价氧化物对应水化物的化学式分别为NaOH和HClO4.④和(11)两元素形成化合物的化学式为NaBr; 该化合物灼烧时的焰色为黄色
(5)第一电离能:⑤>⑥(填“>”“<”“=”),请说明原因:Mg元素原子3s能级容纳2个电子,为全满稳定状态,能量较低.
| 主族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | VII | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ | (11) |
(2)④、⑤、⑥三种元素最高价氧化物对应的水化物中,呈两性的是Al(OH)3.(填化学式)
(3)元素②的氢化物的电子式为
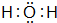 ;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑(4)④和⑦的最高价氧化物对应水化物的化学式分别为NaOH和HClO4.④和(11)两元素形成化合物的化学式为NaBr; 该化合物灼烧时的焰色为黄色
(5)第一电离能:⑤>⑥(填“>”“<”“=”),请说明原因:Mg元素原子3s能级容纳2个电子,为全满稳定状态,能量较低.
19.下列反应的离子方程式正确的是( )
| A. | 氯气通入氢氧化钠溶液中 Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 金属铁与稀硝酸反应 Fe+2H+=Fe2++H2↑ | |
| C. | 在硅酸钠溶液中滴加稀硫酸 SiO32-+2H+=H2SO3↓ | |
| D. | 铜粉与98.3%的硫酸加热下反应 Cu+4H++SO42-=Cu2++SO2↑+2H2O |

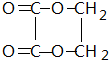 +H2O;n HOCH2CH2OH+n HOOC-COOH
+H2O;n HOCH2CH2OH+n HOOC-COOH 
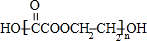 +(2n-1)H2O.
+(2n-1)H2O.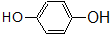 ③
③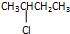
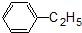 ⑤
⑤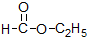 ⑥
⑥