题目内容
7.(1)X原子在第二能层上只有一个空轨道,该元素名称是碳,画出它的原子结构示意图 ,它的电子排布共有3个能级,5个轨道,核外电子有6种运动状态,价电子轨道表示式
,它的电子排布共有3个能级,5个轨道,核外电子有6种运动状态,价电子轨道表示式
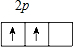 ,原子中能量最高的电子,其电子云在空间有x,y,z3个方向,原子轨道呈现纺锤形,它的最简单氢化物中键角是109°28′,其中心原子杂化类型为sp3,分子中含sp3-s(填成键的原子轨道名称)σ键
,原子中能量最高的电子,其电子云在空间有x,y,z3个方向,原子轨道呈现纺锤形,它的最简单氢化物中键角是109°28′,其中心原子杂化类型为sp3,分子中含sp3-s(填成键的原子轨道名称)σ键(2)Y原子的核电荷数为33,其外围电子排布是4s24p1,其在元素周期表中的位置是第四周期ⅢA族,是属于p区的元素.
分析 (1)X原子在第二能层上只有一个空轨道,则2p轨道上应有2个电子,电子排布式为1s22s22p2,则元素名称是碳,据此分析;
(2)Y原子的核电荷数为33,应为As元素,外围电子排布为4s24p1,位于周期表第四周期ⅢA族.
解答 解:(1)X原子在第二能层上只有一个空轨道,则2p轨道上应有2个电子,电子排布式为1s22s22p2,核电荷数为6,则元素名称是碳,原子结构示意图为: ,电子排布共有3个能级,5个轨道,核外电子有6种运动状态,价电子轨道表示式为:
,电子排布共有3个能级,5个轨道,核外电子有6种运动状态,价电子轨道表示式为:
 ,原子中能量最高的电子为p轨道,其电子云在空间有x,y,z3个方向,原子轨道呈现纺锤形,它的最简单氢化物为CH4中键角是109°28′,其中心原子杂化类型为sp3,分子中含sp3-sσ键,故答案为:碳;
,原子中能量最高的电子为p轨道,其电子云在空间有x,y,z3个方向,原子轨道呈现纺锤形,它的最简单氢化物为CH4中键角是109°28′,其中心原子杂化类型为sp3,分子中含sp3-sσ键,故答案为:碳; ;3;5;6;
;3;5;6;
 ;x,y,z3个;纺锤;109°28′;sp3;sp3-s;
;x,y,z3个;纺锤;109°28′;sp3;sp3-s;
(2)Y原子的核电荷数为33,应为As元素,外围电子排布为4s24p1,位于周期表第四周期ⅢA族,是属于 p区的元素,故答案为:4s24p1;第四周期ⅢA族;p.
点评 本题考查较为综合,涉及原子的核外电子排布,元素在周期表中的位置等知识,侧重于原子结构和元素周期律的考查,题目难度不大,注意把握原子结构特点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.有aXn+和bYm-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
| A. | b-a=n+m | B. | a-b=n+m | C. | b-a=n-m | D. | a+b=n+m |
18.下列离子方程式书写正确的是( )
| A. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+2H2O | |
| B. | 用氨水吸收过量的二氧化硫:NH3•H2O+SO2═NH4++HSO3- | |
| C. | 次氯酸钙溶液中通人过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| D. | 氯化亚铁溶液中加入硝酸:2Fe2++4H++NO3-=2Fe3++2H2O+NO↑ |
15.下列说法正确的是( )
| A. | 杂化轨道不可以参与π键的形成 | B. | 多原子单质分子都是非极性分子 | ||
| C. | 共价键都有方向性 | D. | 共价化合物中可以含有离子键 |
2.已知短周期且为同周期的X、Y、Z三种元素,它们的最高价氧化物的水化物依次为H3XO4、H2YO4、HZO4,下列判断正确的是( )
| A. | 阴离子的还原性按X、Y、Z的顺序增强 | |
| B. | 酸性强弱顺序H3XO4>H2YO4>HZO4 | |
| C. | 单质的氧化性按X、Y、Z的顺序减弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序增强 |
12.既有离子键又有共价键的化合物是( )
| A. | NaCl | B. | H2O | C. | HCl | D. | NaOH |
16.下列物质所有原子一定不在同一平面的是( )
| A. | 乙烯 | B. | 乙炔 | C. | 苯乙烯 | D. | 甲苯 |
17.下列离子方程式中书写正确的是( )
| A. | Al2O3与NaOH溶液反应 Al2O3+2OH-═2 AlO2-+H2O | |
| B. | FeCl2溶液中通入Cl2 Fe2++Cl2═Fe3++2Cl- | |
| C. | FeCl3溶液与铜 Fe3++Cu═Fe2++Cu2+ | |
| D. | 用醋酸除水垢 2H++CaCO3═Ca2++H2O+CO2↑ |
