题目内容
【题目】(1)在质量分数为28%的KOH水溶液中,OH-与H2O数目之比是________。
(2)由硫酸钾、硫酸铁和硫酸组成的混合溶液,其中c(H+)=0.1 mol/L,c(Fe3+)=0.3 mol/L,c(SO42-)=0.6 mol/L,则c(K+)为________。
(3)相同物质的量浓度的氯化钠、氯化镁、氯化铝溶液,分别与硝酸银溶液反应,当生成沉淀的质量之比为3∶2∶1时,消耗三种盐溶液的体积比为________。
(4)某状况下a L氨气(此时气体摩尔体积为Vm)溶解在一定量的水中形成b mL氨水溶液,所得溶液的密度为ρ g/mL,则该氨水的物质的量浓度可表示为________ mol/L;氨水的质量分数为________。
(5)已知1.505×1023个X气体分子的质量是8 g,则X气体的摩尔质量是________。
【答案】1∶8 0.2 mol/L 9∶3∶1 ![]()
![]() ×100% 32g/mol
×100% 32g/mol
【解析】
(1)假设溶液质量为100g,计算KOH、水的质量,再根据n=![]() 计算KOH、水的物质的量,进而计算OH-与H2O数目之比;
计算KOH、水的物质的量,进而计算OH-与H2O数目之比;
(2)根据电荷守恒计算溶液中c(K+);
(3)均发生Ag++Cl-=AgCl↓,设NaCl、MgCl2、AlCl3与硝酸银溶液反应生成AgCl的物质的量分别为3mol、2mol、1mol,根据氯离子守恒计算NaCl、MgCl2、AlCl3的物质的量,再根据V=![]() 可知,溶液浓度相等,体积之比等于物质的量之比;
可知,溶液浓度相等,体积之比等于物质的量之比;
(4)根据n=![]() 计算氨气的物质的量,再根据c=
计算氨气的物质的量,再根据c=![]() 计算溶液物质的量浓度;根据m=n·M计算氨气的质量,根据m=ρ·V计算溶液的质量,氨水的质量分数=
计算溶液物质的量浓度;根据m=n·M计算氨气的质量,根据m=ρ·V计算溶液的质量,氨水的质量分数= ×100%。
×100%。
(5)根据n=![]() 计算气体的物质的量,再根据n=
计算气体的物质的量,再根据n=![]() 计算X气体的摩尔质量。
计算X气体的摩尔质量。
(1)假设溶液质量为100g,则KOH的质量m(KOH)=100g×28%=28g,水的质量m(H2O)=100g-28g=72g,故KOH的物质的量n(KOH)= 28g÷56g/mol=0.5mol、水的物质的量n(H2O)= ![]() =4mol,故溶液中OH-与H2O数目之比=0.5mol:4mol=1:8;
=4mol,故溶液中OH-与H2O数目之比=0.5mol:4mol=1:8;
(2)根据电荷守恒可知:c(K+)+ c(H+)+3c(Fe3+)=2c(SO42-),则:c(K+)+0.1mol/L+3×0.3mol/L=2×0.6mol/L,解得c(K+)=0.2mol/L;
(3)相同浓度的NaCl、MgCl2、AlCl3三种溶液分别与硝酸银溶液反应,当生成沉淀的质量之比为3:2:1,设NaCl、MgCl2、AlCl3与硝酸银溶液反应生成AgCl的物质的量分别为3mol、2mol、1mol,根据氯离子守恒,则n(NaCl)=3mol、n(MgCl2)= ![]() =1mol,n(AlCl3)=
=1mol,n(AlCl3)=![]() mol,再根据V==
mol,再根据V==![]() 可知,溶液浓度相等,体积之比等于物质的量之比,故V(NaCl):V(MgCl2):V(AlCl3)=3mol:1mol:
可知,溶液浓度相等,体积之比等于物质的量之比,故V(NaCl):V(MgCl2):V(AlCl3)=3mol:1mol:![]() mol=9:3:1;
mol=9:3:1;
(4)某状况下气体摩尔体积为VmL/mol,则该状况下aL氨气的物质的量n=![]() mol,溶解在一定量的水中形成b ml氨水溶液,则该氨水的物质的量浓度c=
mol,溶解在一定量的水中形成b ml氨水溶液,则该氨水的物质的量浓度c=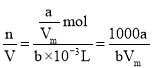 mol/L;所得溶液的密度为ρg/mL,则溶液质量m(溶液)=bρg,氨气的质量m(NH3)=n·M=
mol/L;所得溶液的密度为ρg/mL,则溶液质量m(溶液)=bρg,氨气的质量m(NH3)=n·M=![]() mol×17g/mol=
mol×17g/mol=![]() g,所以氨水的质量分数
g,所以氨水的质量分数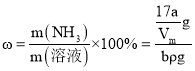 ×100%=
×100%=![]() ×100%;
×100%;
(5) 1.505×1023个X气体分子的物质的量m=![]() =0.25mol,其质量是8 g,则由n=
=0.25mol,其质量是8 g,则由n=![]() 可知X气体的摩尔质量M=
可知X气体的摩尔质量M=![]() =32g/mol。
=32g/mol。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】有X、Y、Z、M、R五种短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | |
原子半径/nm | 0.074 | 0.099 | |||
主要化合价 | +4,-4 | -2 | -1,+7 | ||
其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 第三周期简单离子半径最小 |
请回答下列问题:
(1)Z与NaOH溶液反应的离子方程式:___。(用元素符号表示,下同。)
(2)下列事实能说明R非金属性比Y强这一结论的是___(选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.气态氢化物稳定性R>Y
c.Y与R形成的化合物中Y呈正价
d.Y与R各自形成的含氧酸中R的氧化性更强
(3)经测定X2M2为二元弱酸,写出X2M2的电子式___。其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式___。
(4)已知I2能做X2M2分解的催化剂:
第一步:X2M2+I2=2XIM;
第二步:……
请写出第二步反应的化学方程式___。
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用X2M2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式___。
【题目】I.下列说法不正确的是_____________(填字母代码)。
A.对于Al(OH)3(s) |
B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
C.能源、信息与材料通常被称为现代社会发展的三大支柱 |
D.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
E.除去硬水中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2溶解度比 MgCO3的小
II.向含有AgI的饱和溶液中:
(1)加入固体AgNO3,则c(I-)________(填“变大”、“变小”或“不变”,下同)。
(2)若改加更多的AgI,则c(Ag+)___________。
(3)若改加AgCl固体,则c(I-)___________,而c(Ag+)___________。
III.用“>”、“<”或“=”填空:
(1)25℃时1mol/L FeCl3溶液的pH______80℃时1mol/L FeCl3溶液的pH。
(2)已知NaHSO3溶液中c(HSO3-)>c(SO32-)>c(H2SO3),则溶液中c(H+)______c(OH-)。
(3)常温下,取等物质的量浓度的HA溶液与NaOH溶液等体积混合,测得混合溶液的pH=8,混合溶液中由水电离出的c(H+)水______NaOH溶液中由水电离出的c(H+)水。