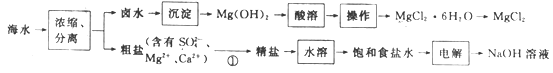
题目内容
【题目】氯酸锶[Sr(ClO3)2]用于制造红色烟火。将氯气通入温热的氢氧化锶溶液制得氯酸锶的实验装置如下。已知氢氧化锶[Sr(OH)2]易与盐酸反应,水中存在Cl﹣时,不影响HCl的溶解,但会抑制Cl2的溶解。回答下列问题

(1)Sr(ClO3)2中Cl元素的化合价是_____,装置A中浓盐酸在反应中的作用是_____
(2)Y是_____(填字母),其作用原理是_____
A.浓H2SO4 B.饱和NaCl溶液 C.NaOH溶液
(3)装置D中NaOH溶液的作用是_____
(4)装置C中三颈烧瓶内发生的反应为6Sr(OH)2+6Cl2=Sr(ClO3)2+6H2O+5SrCl2,转移5mol电子时生成Sr(ClO3)2的质量是_____
【答案】+5 还原性和酸性 B 氯气溶于水达到化学反应平衡:Cl2+H2OH++Cl﹣+HClO,根据平衡移动原理,增大氯离子浓度,抑制了氯气溶解生成盐酸和次氯酸,降低了Cl2溶解度 吸收氯气 127.5g
【解析】
A中浓盐酸和二氧化锰在加热条件下反应生成氯气,B用于除去氯气中的氯化氢,可用饱和食盐水,在C中发生6Sr(OH)2+6Cl2=Sr(ClO3)2+6H2O+5SrCl2,以制备氯酸锶,D为尾气处理装置,避免污染空气。
(1)Sr(ClO3)2中Sr为+2价,O为﹣2价,由化合价代数和为0可知Cl元素的化合价是+5价,装置A中生成氯气,盐酸被氧化,同时生成氯化锰,浓盐酸在反应中的作用是还原性和酸性的作用,故答案为:+5;还原性和酸性;
(2)Y用于除去氯气中的氯化氢,应为饱和食盐水,氯气溶于水,与水反应生成HCl和HClO,溶液中存在化学反应平衡:Cl2+H2OH++Cl﹣+HClO,饱和食盐水中氯离子浓度较大,根据平衡移动原理,增大氯离子浓度,该化学平衡逆向移动,抑制了氯气溶解生成盐酸和次氯酸,降低了Cl2溶解度,所以可以用饱和食盐水收集氯气,故答案为:B;氯气溶于水达到化学反应平衡:Cl2+H2OH++Cl﹣+HClO,根据平衡移动原理,增大氯离子浓度,抑制了氯气溶解生成盐酸和次氯酸,降低了Cl2溶解度;
(3)氢氧化钠和氯气反应,可避免氯气污染环境,则装置D中NaOH溶液的作用是吸收氯气,避免污染环境,故答案为:吸收氯气;
(4)装置C中三颈烧瓶内发生的反应为6Sr(OH)2+6Cl2=Sr(ClO3)2+6H2O+5SrCl2,反应中只有Cl元素化合价变化,Cl元素化合价由0价分别变为+5价、﹣1价,生成1molSr(ClO3)2,转移10mol电子,则转移5mol电子时生成Sr(ClO3)20.5mol,质量是0.5mol×255g/mol=127.5g,故答案为:127.5g。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】某小组在实验室使用软锰矿(主要成分为MnO2)和浓盐酸通过加热制备氯气,并对氯气的性质进行探究。
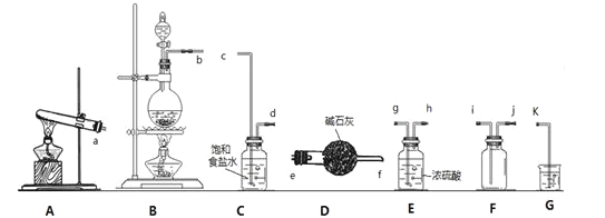
(1)写出实验室制氯气的化学方程式:__。欲制取并收集一瓶于燥的氯气,则“制取→收集”的实验装置连接顺序为__→c→d→__→i→j→k。
(2)装置C中饱和食盐水的作用是___。
(3)该小组同学对氯气性质进行如下探究:
实验步聚 | 实验结论 |
①将氯气通入NaCl溶液中,再加入1mLCCl4振荡,静置,观察四氢化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
②将氯气通入KBr溶流中,再加入1mLCCl4振落,静置,观察四氯化碳层颜色 | |
③将氯气通入KI溶液中,再加入1mLCCl4振荡,静置,观察四氧化碳层颜色 |
该小组的实验设计缺陷是___,改进的办法是__。
(4)常温下,高锰酸钾固体和浓盐酸反应也可制得氯气,该反应的离子方程式为:___。
(5)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的质量之比为__。