题目内容
【题目】如图为工业从海水中提取液溴的流程图:
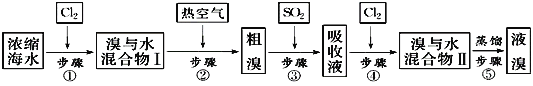
已知:溴的沸点为59℃,微溶于水,有毒性。请回答:
(1)某同学利用下图装置进行步骤①至步骤④的实验,当进行步骤①时,应关闭活塞___,打开活塞____。
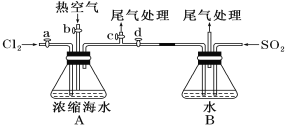
(2)步骤②中可根据___现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是___。
(4)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是___。
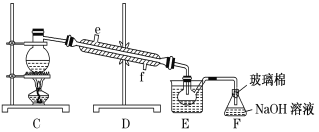
(5)步骤⑤用下图装置进行蒸馏,蒸馏烧瓶中尚未安装温度计,安装其位置时应注意___,装置C中直接加热不合理,应改为__。
【答案】bd ac A中气泡产生的快慢 B中溶液褪色 浓缩Br2或富集溴 温度计的水银球在蒸馏烧瓶的支管口附近 水浴加热
【解析】
向浓缩海水中加入氯气可以将Br-氧化得到溴水的混合物,利用热的空气吹出溴单质,得到粗溴,然后通入SO2气体吸收Br2单质,将Br2富集,二者在溶液中发生氧化还原反应生成HBr,再通入Cl2氧化Br-得到溴与水的溶液,最后蒸馏得到液溴。
(1)进行步骤①的目的是通入Cl2氧化Br-离子为Br2,且能使氯气通入和浓缩海水中的溴离子反应,剩余氯气进行尾气吸收,因此应关闭bd,打开ac,进行反应和尾气处理;
(2)步骤②是利用溴单质易挥发的性质,关闭ac,打开bd,通入热空气把生成的溴单质赶出到装置B,并使Br2蒸气和通入的SO2气体在溶液中发生氧化还原反应生成H2SO4和HBr,依据A装置中直玻璃管产生气泡的快慢现象,简单判断热空气的流速;
(3)步骤③中是二氧化硫和溴单质发生氧化还原反应生成溴化氢和硫酸,反应方程式为:Br2+SO2+2H2O= H2SO4+2HBr,由于溴水显橙色,所以可根据溴水溶液的颜色由橙色变化为无色,来判断反应是否恰好完全进行;
(4)海水中溴元素较少,从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”过程中,的目的是增大溴单质的浓度,起到富集溴元素的作用;
(5)蒸馏装置中温度计的作用是测定馏出成分的温度,因此蒸馏烧瓶中安装温度计,安装其位置时应注意:温度计水银球在蒸馏烧瓶的支管口处;装置C中直接加热温度不容易控制,为使溴单质从溴水中蒸出,可根据溴的沸点为59℃,采用水浴加热的方法。

【题目】实验室用密度为1.18g/ml,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
实际应量取盐酸体积/ml | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
______________ | ______________ | ______________ |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______________;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是_________________________________,溶液注入容量瓶前需恢复到室温,这是因为______________________________________;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作_______________;若加蒸馏水时不慎超过了刻度_______________;若定容时俯视刻度线___________________。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度_______________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面_____________________。