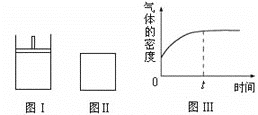
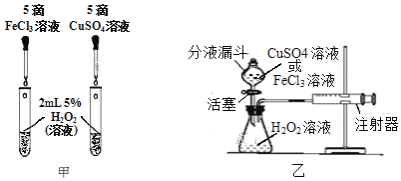
题目内容
【题目】现有含NaCl、MgCl2和Na2SO4的混合溶液,某兴趣小组的同学欲提取纯净的NaCl晶体,设计了如下实验:
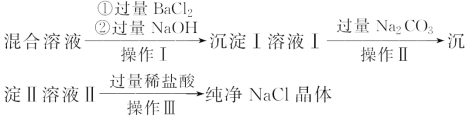
请回答下列问题:
(1)写出沉淀Ⅰ和沉淀Ⅱ所含物质的化学式。沉淀Ⅰ:_________、沉淀Ⅱ:_______。
(2)上述流程中,加入过量稀盐酸的目的是______________。
(3)操作Ⅲ中需使用的玻璃仪器是________________________。
【答案】Mg(OH)2、BaSO4 BaCO3 除去过量的NaOH和Na2CO3 玻璃棒、酒精灯
【解析】
(1)含NaCl、MgCl2和Na2SO4的混合溶液,加入过量的氯化钡、氢氧化钠,分别与SO42-、OH-反应生成BaSO4、Mg(OH)2沉淀;过滤后溶液中含有大量Ba2+、OH-、Na+、Cl-,加入过量Na2CO3,CO32-与Ba2+反应生成BaCO3沉淀;
(2)溶液Ⅱ含有的离子有OH-、Na+、Cl-、CO32-;
(3)提取纯净的NaCl晶体,操作Ⅲ为蒸发结晶,依据蒸发结晶实验选择合适的仪器。
(1)含NaCl、MgCl2和Na2SO4的混合溶液,加入过量的氯化钡、氢氧化钠,分别与SO42-、OH-反应生成BaSO4、Mg(OH)2沉淀,所以沉淀Ⅰ为BaSO4、Mg(OH)2沉淀混合物;过滤后溶液中含有大量的Ba2+、OH-、Na+、Cl-,加入过量Na2CO3,CO32-与Ba2+反应生成BaCO3沉淀,所以沉淀Ⅱ为BaCO3;
(2)溶液Ⅱ含有的离子有OH-、Na+、Cl-、CO32-,要得到纯净的NaCl,应加入盐酸调节溶液的pH=7,使CO32-转化为CO2气体,OH-转化为H2O。所以加入过量稀盐酸的目的是除去除去过量的NaOH和Na2CO3;
(3)从NaCl溶液中获得溶质NaCl,提取纯净的NaCl晶体,操作Ⅲ为蒸发结晶,用到的玻璃仪器有:酒精灯、玻璃棒。

 53随堂测系列答案
53随堂测系列答案