题目内容
7.有关盐类水解的说法不正确的是( )| A. | 盐类的水解过程破坏了纯水的电离平衡 | |
| B. | 盐类的水解是酸碱中和反应的逆反应 | |
| C. | 盐类的水解的结果使盐溶液不一定呈中性 | |
| D. | Na2CO3溶液中,c(Na+)是c(CO32-)的2倍 |
分析 A、盐类水解实质是弱离子交换水电离出的氢离子或氢氧根离子生成弱电解质的过程;
B、盐类水解生成酸和碱是中和反应的逆反应;
C、弱酸根水解显碱性,弱碱阳离子水解显酸性;
D、根据电荷守恒分析.
解答 解:A、盐类水解实质是弱离子交换水电离出的氢离子或氢氧根离子生成弱电解质的过程,破坏了纯水的电离平衡,故A正确;
B、盐类水解反应是盐与水反应生成酸和碱是中和反应的逆反应,故B正确;
C、弱酸根水解显碱性,弱碱阳离子水解显酸性,盐类水解的结果使溶液不一定呈中性,故C正确;
D、Na2CO3溶液中,碳酸根是强碱弱酸盐,酸根离子水解,导致c(Na+)大于c(CO32-)的2倍,故D错误;
故选D.
点评 本题考查了盐类水解放热分析判断,水解实质理解应用,掌握基础是关键,题目较简单.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
17.下列物质均有漂白作用,其漂白原理相同的是( )
①过氧化钠 ②次氯酸 ③双氧水 ④活性炭 ⑤臭氧.
①过氧化钠 ②次氯酸 ③双氧水 ④活性炭 ⑤臭氧.
| A. | ①②③⑤ | B. | 只有①③⑤ | C. | ②③④ | D. | 只有①②⑤ |
18.常温下,在溶液中可发生以下反应:①16H++10Z-+2XO4-═2X2++5Z2+8H2O,②2M2++R2═2M3++2R-,③2R-+Z2═R2+2Z-,由此判断下列说法错误的是( )
| A. | 氧化性强弱顺序为:XO4-<Z2<R2<M3+ | |
| B. | 还原性强弱顺序为:X2+<Z-<R-<M2+ | |
| C. | Z元素在反应①中被氧化,在③中被还原 | |
| D. | 常温下可发生反应2M2++Z2═2M3++2Z- |
15.现有A、B、C、D、E、F六种位于周期表前四周期元素,其原子序数依次增大,相关信息如表所示:
根据以上信息,回答下列问题:
(1)画出元素C的基态价电子排布图: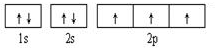 ;F元素位于周期表的d区;B、C、D三种元素的第一电离能由大到小顺序为:N>O>C(用元素符号表示).
;F元素位于周期表的d区;B、C、D三种元素的第一电离能由大到小顺序为:N>O>C(用元素符号表示).
(2)化合物BA2D2蒸气293K时,理论测算密度为2.0g•L-1,实际密度为2.5g•L-1的原因是甲酸形成分子间氢键.
(3)ED2中F原子的杂化类型为sp2; ED2易溶于水的原因可能是:①②(填入序号).
①ED2与水极性相同 ②ED2可以与水反应
(4)有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为:离子键、共价键.
| 元素 | 性质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| F | 该元素的一种氧化物M可用作油漆颜料,与某单质反应可应用于焊接钢轨 |
(1)画出元素C的基态价电子排布图:
 ;F元素位于周期表的d区;B、C、D三种元素的第一电离能由大到小顺序为:N>O>C(用元素符号表示).
;F元素位于周期表的d区;B、C、D三种元素的第一电离能由大到小顺序为:N>O>C(用元素符号表示).(2)化合物BA2D2蒸气293K时,理论测算密度为2.0g•L-1,实际密度为2.5g•L-1的原因是甲酸形成分子间氢键.
(3)ED2中F原子的杂化类型为sp2; ED2易溶于水的原因可能是:①②(填入序号).
①ED2与水极性相同 ②ED2可以与水反应
(4)有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为:离子键、共价键.
12.下列关于焰色反应的说法正确的是( )
| A. | 只有金属化合物才有焰色反应 | |
| B. | 焰色反应是化学变化 | |
| C. | 透过蓝色钴玻璃观察钾元素焰色反应的颜色为紫色 | |
| D. | 每次焰色反应实验后都要将铂丝蘸取氢氧化钠溶液洗涤并灼烧 |
19.下列反应属于吸热反应的是( )
| A. | 酸碱中和反应 | B. | 氢气的燃烧 | ||
| C. | 锌与硫酸反应 | D. | 碳与二氧化碳反应 |
16.常温下,下列关于NaOH溶液和氨水的说法正确的是( )
| A. | 相同物质的量浓度的两溶液中的c(OH-)相等 | |
| B. | pH=13的两溶液稀释100倍,pH都为11 | |
| C. | 两溶液中分别加入少量NH4Cl固体,c(OH-)均减小 | |
| D. | 体积相同、pH相同的两溶液能中和等物质的量的盐酸 |
17.下列说法正确的是(NA表示阿伏加德罗常数)( )
| A. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| B. | 1 molFe与足量的Cl2反应转移的电子数为2NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 常温常压下,1 mol氦气含有的原子数为2NA |