题目内容
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为0.1mol。若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
(1)若向该溶液中加入过量的稀硫酸和KSCN溶液,现象是: ;
(2)写出向该溶液中加入过量的稀硫酸发生反应的离子方程式为:________________________________________________________________________;
(3)经分析,该溶液仅含的4种离子是:______________________________________;
(4)判定另外3种离子不能存在的主要依据有三个:
①向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变,②所含离子的物质的量均为0.1mol,则③是__________________________________________;
(5) 若向该溶液中加入足量的NaOH溶液,将所得的沉淀过滤再灼烧,最后所得固体的质量为______g
(1)有气泡产生,溶液呈红色 ;
(2)3 Fe2+ + NO3- + 4 H+ =" 3" Fe3+ + NO↑ + 2 H2O ;
(3)Fe2+、SO42-、NO3-、Na+;
(4)溶液中离子的电荷守恒 ;
(5)8
解析试题分析:由题意“若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变”可知含有Fe2+、SO42-、NO3-;而且由于发生反应3 Fe2+ + NO3- + 4 H+ =" 3" Fe3+ + NO↑ + 2 H2O ;而产生气体,
又因为含有的离子的物质的量相等,由电荷守恒确定含有Na+;Fe2+的物质的量为0.1mol,“若向该溶液中加入足量的NaOH溶液,将所得的沉淀过滤再灼烧,”最后得到的固体为Fe2O3物质的量为0.05mol,质量为0.05mol×160g/mol=8g。
考点:离子推断。

 阅读快车系列答案
阅读快车系列答案化合物A、B是中学常见的物质,其阴阳离子只能从下表中选择:
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH4+、Ca2+ |
| 阴离子 | OH-、NO3—、I-、HCO3—、AlO2—、HSO4— |
(1)若A、B的水溶液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝的气体。
①B的化学式为________________。
②A、B溶液混合加热反应的离子方程式为________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A的化学式为____________________。
②经分析上述过程中溶液变黄的原因可能有两种(用离子方程式表示):
i________________________________;ii_______________________________,
③请用一简易方法证明上述溶液变黄的原因:________。
④利用溶液变黄原理,将其设计成原电池,若电子由a流向b(a、b均为石墨电极),则b极的电极反应式为____________________。
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、CO32-、SO42-. 现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2 溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- : ,原因是 .
(2)由第二份进行的实验可知混合物中应含有 离子,其物质的量浓度为 .
(3)由第三份进行的实验可知12.54g 沉淀的成份为 。请计算形成该沉淀的原混合物中各离子的物质的量。(要求计算过程)
(4)综合上述实验,你认为以下结论正确的是
| A.该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol |
| B.该混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl- |
| C.该混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl- |
| D.该混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl- |

 Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN-
Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN-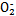 可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。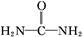 )与N
)与N