题目内容
高锰酸钾在实验室和工农业生产中有广泛的用途.实验室以二氧化锰为主要原料制备高锰酸钾。其部分流程如下:
(1)第①步加热熔融应在 中进行.而不用瓷坩埚的原因是 (用化学程式表示)。
(2)第④步通入CO2,可以使Mn片发生反应.生成MnO4—和MnO2。反应的离子方程式为 。则完成反应时,转化为KMnO4的占全部K2MnO4的百分率约为 (精确到0.1%)。
(3)第⑤步趁热过滤的是 。
(4)第⑥步加热浓缩至液面有细小晶体析出时.停止加热.冷却结晶、 、洗涤、干燥。干燥过程中.温度不宜过高.其原因是 (用化学方程式表示)。
(5)H2O2和KMnO4,都是常用的强氧化剂。若向H2O2溶液中滴加酸性高锰酸钾溶液.则酸性高锰酸钾溶液会褪色.写出该反应的离子方程式: .该反应说明H2O2的氧化性比KMnO4 (填“强”或“弱”)。
(1)铁坩埚;SiO2+2KOH K2SiO3+H2O
K2SiO3+H2O
(2)3MnO42-+2CO2 2MnO4-MnO2↓+2CO32-(或其他合理答案);66.7%
2MnO4-MnO2↓+2CO32-(或其他合理答案);66.7%
(3)减少过滤的损耗(或防止降温过程中KMnO4析出而损耗)
(4)过滤;2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(5)2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O;弱
解析试题分析:(1)由于KOH是强碱,在加热及高温时容易与玻璃、陶瓷中的SiO2发生反应,该反应的方程式为:SiO2+2KOH K2SiO3+H2O。所以加热熔融KClO3和KOH的混合物应在铁坩埚中进行。(2)根据题意结合原子守恒和电荷守恒,可得该反应的方程式为:3MnO42-+2CO2
K2SiO3+H2O。所以加热熔融KClO3和KOH的混合物应在铁坩埚中进行。(2)根据题意结合原子守恒和电荷守恒,可得该反应的方程式为:3MnO42-+2CO2 2MnO4-+MnO2↓+2CO32-。由方程式可看出,每有3mol的K2MnO4发生反应,就生成2mol的KMnO4。所以转化为KMnO4的K2MnO4的转化率为:2÷3×100%=66.7%。(3)由于KMnO4的溶解度随温度的升高而增大,随温度的降低而减小。趁热过滤就可以减少过滤过程中KMnO4的损耗。(4)第⑥ 步加热浓缩至液面有细小晶体析出时.停止加热.冷却结晶、过滤、洗涤、干燥。KMnO4受热容易发生分解反应:2KMnO4
2MnO4-+MnO2↓+2CO32-。由方程式可看出,每有3mol的K2MnO4发生反应,就生成2mol的KMnO4。所以转化为KMnO4的K2MnO4的转化率为:2÷3×100%=66.7%。(3)由于KMnO4的溶解度随温度的升高而增大,随温度的降低而减小。趁热过滤就可以减少过滤过程中KMnO4的损耗。(4)第⑥ 步加热浓缩至液面有细小晶体析出时.停止加热.冷却结晶、过滤、洗涤、干燥。KMnO4受热容易发生分解反应:2KMnO4 K2MnO4+MnO2+O2↑。为了防止KMnO4的分解,所以在干燥时温度不宜过高。(5)KMnO4和H2O2都有强的氧化性,但KMnO4的氧化性更强,所以二者发生反应时H2O2作还原剂,把KMnO4还原为无色的Mn2+,而使溶液褪色。该反应说明H2O2的氧化性比KMnO4弱。
K2MnO4+MnO2+O2↑。为了防止KMnO4的分解,所以在干燥时温度不宜过高。(5)KMnO4和H2O2都有强的氧化性,但KMnO4的氧化性更强,所以二者发生反应时H2O2作还原剂,把KMnO4还原为无色的Mn2+,而使溶液褪色。该反应说明H2O2的氧化性比KMnO4弱。
考点:考查化学实验基本操作、化学方程式和离子方程式的书写、高锰酸钾的制法、性质、产率的计算等知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验。
实验①:取少量KI溶液于试管中,先加入溴水、振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色;
实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈红色。
(1)写出离子方程式:
实验①:__________________________________________________________;
实验②:__________________________________________________________。
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是________。
| A.Br2>I2 | B.Fe3+>Br2 |
| C.Br2>Fe3+ | D.I->Br- |
①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液
__________________________________________________________________
__________________________________________________________________
Ⅰ.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为 。
其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命。以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为 。
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为:2Al+3Ag2O+2NaOH+3H2O 2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
,正极附近溶液的pH (填“变大”、“不变”或“变小”)。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。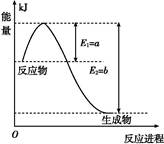
(1)如图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
| A.增大压强 | B.增大反应物的浓度 |
| C.使用催化剂 | D.降低温度 |
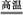 6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验。
实验①:取少量KI溶液于试管中,先加入溴水、振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色;
实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈红色。
(1)写出离子方程式:
实验①:______________________________________________________;
实验②:______________________________________________________。
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是________。
| A.Br2>I2 | B.Fe3+>Br2 | C.Br2>Fe3+ | D.I->Br- |
①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液
 白色沉淀
白色沉淀 沉淀不溶解
沉淀不溶解