题目内容
【题目】原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素。回答下列问题:
(1)甲能形成多种常见单质,在熔点很高的两种常见单质中,原子的杂化方式分别为______、__________。
(2)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第________电离能。
(3)戊的基态原子有________种形状不同的原子轨道;
(4)甲、乙分别都能与丙形成原子个数比为 1:3的微粒,则该两种微粒的空间构型分别为:_________________ ;__________________。
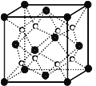
(5)丙和丁形成的一种离子化合物的晶胞结构如右图,该晶体中阳离子的配位数为_________ 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_______________。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,该化合物的相对分子质量为 M,则该晶胞中黑球的半径r =_____cm。(用含ρ、NA的计算式表示)
【答案】 sp2 sp3 二 3 平面三角形 平面三角形 8 正方体(立方体) 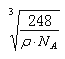
【解析】甲、乙、丙原子序数依次递增,甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2,故甲、乙、丙分别是C、N、O,戊元素是周期表中ds区的第一种元素,所以戊为Cu,丁与戊原子序数相差18,则丁为Na,由分析知甲、乙、丙、丁、戊分别是C、N、O、Na、Cu元素,
(1)碳单质中熔点较高的有金刚石和石墨,金刚石中碳原子全部形成4个共价键,所以是sp3杂化,而石墨层状结构,碳原子形成3个共价键,所以是sp2杂化,故答案为:sp2;sp3;
(2)钠是第IA元素,最外层有1个电子,失去1个电子后,就达到稳定结构,再失电子会很困难,所以电离能突增应出现在第二电离能,故答案为:二;
(3)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,可以看出铜原子的基态原子轨道是s、p、d,所以有3种形状不同的原子轨道,故答案为:3;
(4)甲、乙都能和丙形成原子个数比为1:3的常见微粒分别是CO32-、NO3-,中心原子含σ键电子对数为3对,CO32-含有的电子对数=3+![]() =3,NO3-含有的电子对数=3+
=3,NO3-含有的电子对数=3+![]() =3,所以都是平面三角形结构,故答案为:平面三角形;平面三角形;
=3,所以都是平面三角形结构,故答案为:平面三角形;平面三角形;
(5)根据晶胞(Na2O)结构可知N(Na+):N(O2-)=2:1,根据晶胞结构,顶点和面心处微粒的数目为8×![]() +6×
+6×![]() =4,内部的微粒数目为8,所以顶点和面心处是阴离子,阳离子全部在晶胞内,所以与钠离子最近的阴离子是4个,即配位数是4.而距一个阴离子周围最近的所有阳离子为顶点构成的几何体是正方体.该晶胞中含有4个阴离子,所以有
=4,内部的微粒数目为8,所以顶点和面心处是阴离子,阳离子全部在晶胞内,所以与钠离子最近的阴离子是4个,即配位数是4.而距一个阴离子周围最近的所有阳离子为顶点构成的几何体是正方体.该晶胞中含有4个阴离子,所以有![]() =4,解得a=
=4,解得a=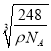 ,故答案为:8;正方体(立方体);
,故答案为:8;正方体(立方体); 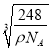 。
。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案