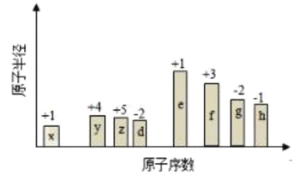
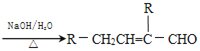题目内容
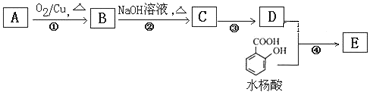
【题目】实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾[KAl(SO4)2·12H2O]的过程如图所示。下列说法正确的是
![]()
A. 试剂①可选用盐酸或NaOH溶液
B. 过滤操作中使用的玻璃仪器只有漏斗、烧杯
C. 滤液A到沉淀B的反应中无CO2生成
D. 最后一步操作是蒸发结晶
【答案】C
【解析】
A.铁和镁和铝都能和盐酸反应,但只有铝和氢氧化钠溶液反应,为防止Fe、Mg杂质干扰,试剂①只能选择NaOH溶液,A项错误;
B.项过滤操作中使用的玻璃仪器有漏斗、烧杯和玻璃棒,B项错误;
C项滤液A为铝和氢氧化钠反应生成偏铝酸钠,偏铝酸根和碳酸氢根反应生成氢氧化铝沉淀和碳酸根离子,反应的离子方程式为:AlO2- + HCO3- + H2O = Al(OH)3↓ + CO32-,无CO2生成,C项正确;
D项制备明矾含有结晶水,不能用蒸发结晶的方法,应采用“蒸发浓缩、冷却结晶”的方法,D项错误。
故选C。

【题目】在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
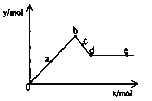
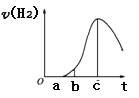
(1)下图表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
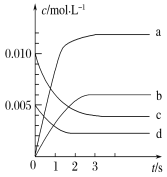
(2)能说明该反应已达到平衡状态的是________(填字母,下同)。
a. v(NO2)、v(O2)、v(NO)相等
b. 容器内各物质浓度保持不变
c. 该反应v逆=v正
d. 容器内总质量保持不变
(3)为使该反应的反应速率增大,下列措施正确的是________。
a 及时分离出NO2气体 b 适当升高温度
c 增大O2的浓度 d 选择高效催化剂