题目内容
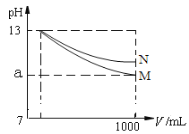
【题目】为探究外界条件对可逆反应:2NO2 (g)![]() 2NO(g) +O2 (g)ΔH=- 1162kJ·mol-1 的影响,若保持气体的总质量不变,在温度为 T1、T2 时,通过实验得到平衡体系中 NO 体积分数随压强的变化曲线,实验结果如图所示。下列说法正确的是
2NO(g) +O2 (g)ΔH=- 1162kJ·mol-1 的影响,若保持气体的总质量不变,在温度为 T1、T2 时,通过实验得到平衡体系中 NO 体积分数随压强的变化曲线,实验结果如图所示。下列说法正确的是

A.a、c 两点混合气体的平均相对分子质量:Ma>Mc
B.b、c 两点的平衡常数:Kb=Kc
C.从状态a 到状态c,NO2 气体的转化率减小
D.T1<T2
【答案】C
【解析】
A. 由图象可知,a、c两点都在等温线上,c的压强大,增大压强,化学平衡逆向移动,c点时气体的物质的量小,混合气体的总质量不变,则平均相对分子质量大,即Ma<Mc,故A错误;
B. 由图象可知,b、c两点的温度不同,平衡常数:Kb≠Kc,故B错误;
C. 由图象可知,a、c两点都在等温线上,c的压强大,增大压强,化学平衡逆向移动,NO2 气体的转化率减小,故C正确;
D. 由图象可知,b、a两点的压强相等,温度不同,NO的体积分数b<a,说明从a到b平衡逆向移动,2NO2 (g)![]() 2NO(g) +O2 (g)ΔH=- 1162kJ·mol-1是放热反应,升高温度,平衡逆向移动,故T1>T2,故D错误;
2NO(g) +O2 (g)ΔH=- 1162kJ·mol-1是放热反应,升高温度,平衡逆向移动,故T1>T2,故D错误;
正确答案是C。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案【题目】80℃时,1L 密闭容器中充入0.20 mol N2O4,发生反应N2O4![]() 2NO2 △H = + Q kJ·mol﹣1(Q>0),获得如下数据:
2NO2 △H = + Q kJ·mol﹣1(Q>0),获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol·L﹣1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
下列判断正确的是
A. 升高温度该反应的平衡常数K减小
B. 20~40s 内,v(N2O4)= 0.004 mol·L-1·s-1
C. 100s时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大
D. 反应达平衡时,吸收的热量为0.15Q kJ