题目内容
【题目】下列有关化学用语的表示正确的是![]()
![]()
A.硫酸铁的化学式:![]()
B.![]() 的结构示意图:
的结构示意图: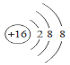
C.![]() 的电子式:
的电子式:![]()
![]()
D.小苏打电离方程式:![]()
【答案】B
【解析】
A.硫酸铁中铁为+3价,硫酸根为-2价,根据十字交叉法,铁右下角数字为2,硫酸根右下角数字为3,化学式为Fe2(SO4)3,故A错误;
B.硫元素的核电荷数为16,则硫原子核内有16个质子,核外有16个电子,S2-表示得到2个电子,核外有18个电子,各层电子数分别为2,8,8,则S2-结构示意图为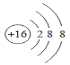 ,故B正确;
,故B正确;
C.CO2为共价化合物,其分子中含有两个碳氧双键,结构式为O=C=O,电子式为![]() ,故C错误;
,故C错误;
D.NaHCO3只能完全电离为Na+和HCO3-,碳酸氢根离子为多元弱酸的酸式根离子,不能拆,其电离方程式为NaHCO3=Na++HCO3-,故D错误;
答案为B。

 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
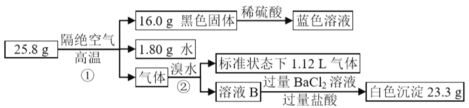
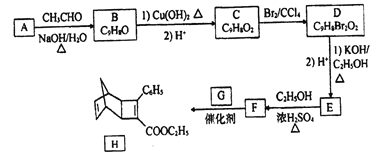
快乐暑假暑假能力自测中西书局系列答案【题目】下表是A、B、C、D、E五种有机物的有关信息:
A | B | C | D | E |
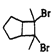
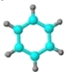
①能使溴的四氯化碳溶液褪色; ②比例模型为: ③能与水在一定条件下反应生成C | ①由C、H两种元素组成; ②球棍模型为: | 分子式为C2H6O,能与E酯化 | ①相对分子质量比C少2; ②能由C氧化而成; | ①由C、H、O三种元素组成; ②球棍模型为: |
根据表中信息回答下列问题:
(1)A到E中,属于烃的是__________(填字母);写出A与溴水反应的化学方程式__________。
(2)B具有的性质是__________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水小 ⑤可使酸性高锰酸钾溶液和溴水均褪色
(3)写出C、D 结构简式:__________、__________。
(4)E 中含氧官能团的名称__________。
【题目】现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____。
A.c(H+) B. c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中的 c(H+)/c(CH3COOH) 比值将________(填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)______(填“>”“<”或“=”)V(乙)。
(4)已知25℃时,下列酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=4.7×10-11 | 3.0×10-8 | K1=1.54×10-2 K2=1.02×10-7 |
①下列微粒可以大量共存的是______![]() 填字母
填字母![]() 。
。
a.CO32-、HSO3- b.HCO3-、HSO3-
c.SO32-、HCO3- d.CO32- 、H2CO3
②写出下列反应的离子方程式:
H2SO3+Na2CO3(少量):_______________
室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
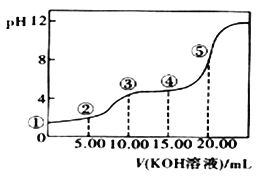
(5)点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)=_____mol/L。点⑤所示的溶液中各离子浓度的大小顺序_____.
(6)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取mg草酸晶体于锥形瓶中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是_______;该过程中发生反应的离子方程式为________;滴定过程中消耗VmLKMnO4标准溶液,草酸晶体纯度为________。